
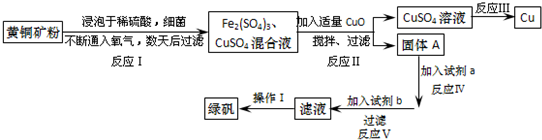
| Fe2+ | Cu2+ | Fe3+ | |
| ��ʼת���������������ʱ��pH | 7.6 | 4.7 | 2.7 |
| ��ȫת���������������ʱ��pH | 9.6 | 6.7 | 3.7 |
���� ��ͭ����Ҫ�ɷ���CuFeS2������������SiO2����������һ��ϸ��������ˮ��Һ�У�����ͨ�����������˵õ�������������ͭ�Ļ����Һ��������������ͭ����pH������������Ϊ�������������ˣ�����AΪ������������Һ��������ͭ�����ɵ�ͭ���ʣ�
����AΪ��������������ϡ�����ܽ�õ���������Һ�������м��������Fe����������Ӧ�����������������˶������������ҺŨ�����ᾧ�����˵õ��̷����ݴ˷������
��� �⣺��1����������������ͭ�Ļ����Һ��������������ͭ��Fe3+����Һ�д��ڴ���ƽ��Fe3++3H2O?Fe��OH��3+3H+������CuO������Һ�е�H+��ʹc��H+����С��ʹFe3+ת��ΪFe��OH��3��������ȥ�������ͭ�����Ҳ��������ʣ�
�ʴ�Ϊ��Fe3+����Һ�д��ڴ���ƽ��Fe3++3H2O?Fe��OH��3+3H+������CuO������Һ�е�H+��ʹc��H+����С��ʹFe3+ת��ΪFe��OH��3��������ȥ�������ͭ�����Ҳ��������ʣ�
��2����Ӧ��Ϊ�������ͭ��Һ�Ƶ�ͭ�ķ�Ӧ����ѧ����ʽΪ��2CuSO4+2H2O$\frac{\underline{\;ͨ��\;}}{\;}$2Cu+2H2SO4+O2����
�ʴ�Ϊ��2CuSO4+2H2O$\frac{\underline{\;ͨ��\;}}{\;}$2Cu+2H2SO4+O2����
��3���Լ�b�������ǻ�ԭ�����ӣ�ΪFeʱ�ܻ�ԭ������Ϊ���������Ҳ����������ʣ�
�ʴ�Ϊ��Fe��
��4��������������ҺŨ�����ᾧ�����˵õ��̷���
�ʴ�Ϊ���ᾧ�����ˣ�
��5����ӦIΪ����ͭ����Ҫ�ɷ���CuFeS2������������SiO2�������������εķ�Ӧ����ѧ����Ϊ��4CuFeS2+2H2SO4+17O2=4CuSO4+2Fe2��SO4��3+2H2O��
�ʴ�Ϊ��4CuFeS2+2H2SO4+17O2=4CuSO4+2Fe2��SO4��3+2H2O��
���� ���⿼�����ʵ��Ʊ�ʵ�鼰�����ķ�����ᴿ��Ϊ��Ƶ���㣬��������ͼ��ÿһ�������ķ�Ӧ�����������ǽⱾ��ؼ���ע���������Ϣ��𣬲��ط�����ʵ�������Ŀ��飬��Ŀ�Ѷ��еȣ�


 �ǻۿ����ܾ�100�ֵ�Ԫ���ؼ��ϵ�д�
�ǻۿ����ܾ�100�ֵ�Ԫ���ؼ��ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
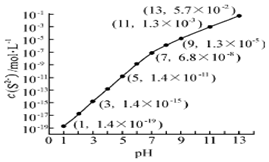 ��Ȼ���д�����SԪ�أ��������������Ҫ�����ã�
��Ȼ���д�����SԪ�أ��������������Ҫ�����ã�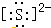 ��
��| Ka1 | Ka2 | |
| H2SO3 | 1.3��10-2 | 6.3��10-4 |
| H2CO3 | 4.2��10-7 | 5.6��10-11 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
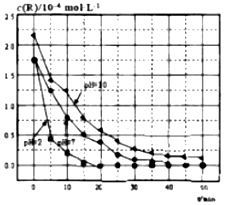
| A�� | �Ա�pH=7��pH=10�����ߣ���ͬһʱ�̣���˵��R����ʼŨ��Խ��������Խ�� | |
| B�� | �Ա�pH=2��pH=7�����ߣ�˵����Һ����Խǿ��R�Ľ�������Խ�� | |
| C�� | ��0��20min֮�䣬pH=2ʱR��ƽ����������Ϊ0.0875��10-4mol•L-1•min-1 | |
| D�� | 50minʱ��pH=2��pH=7ʱR�Ľ���ٷ������ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | �ں�Al3+����ΪNA��AlCl3��Һ�У�Cl-����Ϊ3NA | |
| B�� | 32 g Cu��32 g S��ַ�Ӧ��ת�Ƶĵ�����Ϊ0.5NA | |
| C�� | 1 mol Si�к��й��ۼ���ĿΪ4NA | |
| D�� | ��״���£�22.4 L�״��к��е�C-H����ĿΪ3NA |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ���ѡ��
| A�� | 0.1mol•L-1NaHCO3��Һ��c��Na+����c��HCO3-����c��CO32-����c��H2CO3�� | |
| B�� | 0.1mol•L-1NaOH��Һ��ͨ��SO2������pH=7��c��Na+��=c��HSO3-��+2 c��SO32-��+c��H2SO3�� | |
| C�� | �����ʵ���Ũ�ȵ�CH3COOH��Һ��NaOH��Һ�������Ϻ�����pH=9����Һ��c��OH-��-c��CH3COOH��=c��H+��=l��10-9mol•L-1 | |
| D�� | 20 mL0.1mol•L-1CH3COONa��Һ��10 mL 0.1mol•L-1HCl��Һ��ϵõ�����Һ��c��CH3COOH��+2c��H+��=c��CH3COO-��+2c��OH-�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
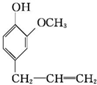 �����������ƿ���ܰ���㾫�Լ����춡��Ӻ������صȣ��ϳɶ�����ӵ�һ��·�����£�
�����������ƿ���ܰ���㾫�Լ����춡��Ӻ������صȣ��ϳɶ�����ӵ�һ��·�����£�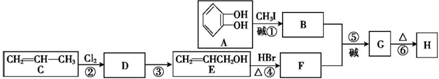
 ��X����±��ԭ�ӣ���
��X����±��ԭ�ӣ���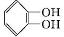 +CH3I$\stackrel{��}{��}$
+CH3I$\stackrel{��}{��}$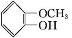 +HI��
+HI��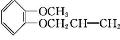 ��
��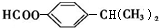 ����дһ�֣���
����дһ�֣���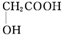 ����������AΪԭ�Ͼ����²���ɺϳ��ڱ������������
����������AΪԭ�Ͼ����²���ɺϳ��ڱ������������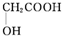 $\stackrel{��Ӧ������}{��}$G$��_{��A/��}^{��Na_{2}CO_{3}��Һ}$H$\stackrel{�ữ}{��}$$\stackrel{��Ӧ������}{��}$
$\stackrel{��Ӧ������}{��}$G$��_{��A/��}^{��Na_{2}CO_{3}��Һ}$H$\stackrel{�ữ}{��}$$\stackrel{��Ӧ������}{��}$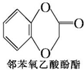
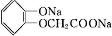 ��
���鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | �������ľ���ϩ��ĭֱ������ | B�� | ���շϾɵ����������ս��� | ||
| C�� | ��������ֱ����Ϊ����ι������ | D�� | ����ũ������Ʊ����� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | �������ܷų�H2����Һ�У�NH4+��Na+��Cl-��Br- | |
| B�� | ˮ�������c��H+��=10-13mol•L-1����Һ�У�Fe3+��K+��CO32-��SO32- | |
| C�� | �����£�$\frac{{K}_{W}}{c��{H}^{+}��}$=0.1mol•L-1����Һ�У�Al3+��Na+��SiO32-��HCO3- | |
| D�� | ʹʯ�������Һ�У�Fe2+��K+��ClO-��SO42- |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com