
| A. | c(HCOO-)>c(Na+) | B. | c(HCOOH)<c(HCOO-) | ||
| C. | c(HCOOH)+c(HCOO-)=0.02mol•L-1 | D. | 2c(H+)+c(HCOOH)=c(HCOO-)+2c(OH-) |
分析 25℃时,将0.02 mol•L-1的HCOOH溶液与0.01mol•L-1的NaOH溶液等体积混合,HCOOH+NaOH=HCOONa+H2O,得到等浓度的HCOOH和HCOONa,所得溶液的pH<7,说明电离大于水解,结合溶液中电荷守恒、物料守恒计算分析;
解答 解:25℃时,将0.02 mol•L-1的HCOOH溶液与0.01mol•L-1的NaOH溶液等体积混合,HCOOH+NaOH=HCOONa+H2O,得到等浓度的HCOOH和HCOONa,所得溶液的pH<7,说明电离大于水解,结合溶液中电荷守恒、物料守恒分析,
A、上述分析可知溶液显酸性甲酸电离大于甲酸根离子水解,c(HCOO-)>c(Na+),故A正确;
B、上述分析可知溶液显酸性甲酸电离大于甲酸根离子水解,c(HCOOH)<c(HCOO-),故B正确
C、溶液中存在物料守恒c(HCOOH)+c(HCOO-)=0.01mol•L-1 ,故C错误;
D、溶液中存在物料守恒c(HCOOH)+c(HCOO-)=2c(Na+),电荷守恒c(H+)+c(Na+)=c(HCOO-)+c(OH-),计算得到,2c(H+)+c(HCOOH)=c(HCOO-)+2c(OH-),故D正确;
故选C.
点评 本题考查了电解质溶液中离子浓度大小比较,电荷守恒、物料守恒的计算分析判断,掌握基础是解题关键,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | NaOH固体 | B. | NaCl固体 | C. | H2O | D. | CaCO3固体 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 乙烯气相直接水合反应,在其他条件相同时,分别测得C2H4的平衡转化率在不同压强(P1、P2)下随温度变化的曲线如图.结合曲线归纳平衡转化率
乙烯气相直接水合反应,在其他条件相同时,分别测得C2H4的平衡转化率在不同压强(P1、P2)下随温度变化的曲线如图.结合曲线归纳平衡转化率查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
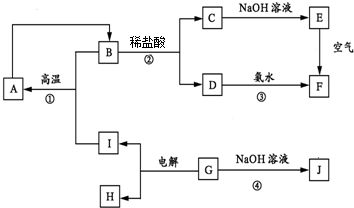
 ,E的化学式为Fe(OH)2.
,E的化学式为Fe(OH)2.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
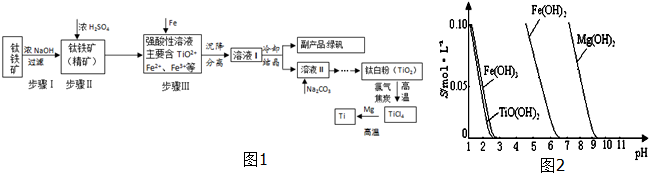
| TiCl4 | Mg | MgCl2 | Ti | |
| 熔点/℃ | -25.0 | 648.8 | 714 | 1667 |
| 沸点/℃ | 136.4 | 1090 | 1412 | 3287 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
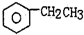 (g)$\stackrel{560℃}{?}$
(g)$\stackrel{560℃}{?}$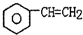 (g)+H2(g)△H<0
(g)+H2(g)△H<0| A. | 加入适当催化剂,可以提高乙苯的转化率 | |
| B. | 在保持体积一定的条件下,充入较多的乙苯,可以提高乙本的转化率 | |
| C. | 在加入乙苯至达到平衡过程中,混合气体的平均相对分子质量不变 | |
| D. | 仅从平衡移动的角度分析,工业生产苯乙稀选择恒压条件优于恒容条件 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 离子半径 Z>X | B. | 最外层电子数 Z>Y | ||
| C. | 金属性 Z>X | D. | 原子半径 Z>Y |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com