
【题目】中科院设计了一种新型的多功能复合催化剂,实现了CO2直接加氢制取高辛烷值汽油,其过程如图。下列有关说法正确的是( )
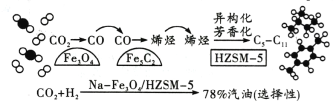
A.在Na-Fe3O4上发生的反应为CO2+H2=CO+H2O
B.中间产物Fe5C2的生成是实现CO2转化为汽油的关键
C.催化剂HZMS-5可以提高汽油中芳香烃的平衡产率
D.该过程,CO2转化为汽油的转化率高达78%
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A.常温下,将![]() 的醋酸溶液稀释到原体积的10倍后,溶液的
的醋酸溶液稀释到原体积的10倍后,溶液的![]()
B.在含有![]() 沉淀的溶液中加入
沉淀的溶液中加入![]() 固体,
固体,![]() 增大
增大
C.![]() 时,用醋酸溶液滴定等浓度NaOH溶液至
时,用醋酸溶液滴定等浓度NaOH溶液至![]() ,
,![]() 醋酸
醋酸![]()
D.在![]() 溶液中加入适量
溶液中加入适量![]() ,可使
,可使![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关实验操作的说法正确的是![]()
A.可用25mL碱式滴定管量取![]()
![]() 溶液
溶液
B.用pH试纸测定溶液的pH时,需先用蒸馏水润湿试纸
C.用盐酸滴定NaOH溶液时,既可选甲基橙作指示剂又可选酚酞作指示剂
D.用盐酸滴定NaOH溶液时,锥形瓶中有水,误差偏小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列说法正确的是( )
A.标况下,22.4LCl2溶于足量水,所得溶液中Cl2、Cl-、HClO和ClO-四种微粒总数为NA
B.标准状况下,38g3H2O2中含有4NA共价键
C.常温下,将5.6g铁块投入一定量浓硝酸中,转移0.3NA电子
D.一定温度下,1L0.50mol/LNH4Cl溶液与2L0.25mol/LNH4Cl溶液含NH4+的物质的量一定不相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】科学工作者研发了一种 SUNCAT的系统,借助锂循环可持续合成氨,其原理如下图所示。下列说法不正确的是

A. 过程I得到的Li3N中N元素为—3价
B. 过程Ⅱ生成W的反应为Li3N+3H2O===3LiOH+NH3↑
C. 过程Ⅲ中能量的转化形式为化学能转化为电能
D. 过程Ⅲ涉及的反应为4OH--4e-=O2↑+2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,向0.1mol/LCH3COOH溶液中逐渐加入NaOH固体,恢复至原温度后溶液中的关系如图所示(忽略溶液体积变化)。下列有关叙述不正确的是( )

A.CH3COOH的Ka=1.0×10-4.7
B.C点的溶液中:c(Na+)>c(CH3COO-)>c(OH-)>c(H+)
C.B点的溶液中:c(Na+)+c(H+)=c(CH3COOH)+c(OH-)
D.A点的溶液中:c(CH3COO-)+c(H+)+c(CH3COOH)-c(OH-)=0.1mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】H2O2分解速率受多种因素影响。实验测得 70 ℃时不同条件下H2O2浓度随时间的变化如图所示。下列说法正确的是
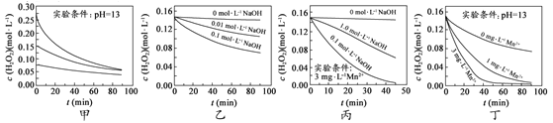
A.图甲表明,其他条件相同时,H2O2浓度越小,其分解速率越快
B.图乙表明,其他条件相同时,溶液pH越小,H2O2分解速率越快
C.图丙表明,少量Mn 2+存在时,溶液碱性越强,H2O2分解速率越快
D.图丙和图丁表明,碱性溶液中,Mn2+对H2O2分解速率的影响大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CH4超干重整CO2技术可得到富含CO的化工原料。回答下列问题
(1)CH4超干重整CO2的催化转化如图所示:

①关于上述过程Ⅱ的说法不正确的是________(填序号)。
a.实现了含碳物质与含氢物质的分离
b.可表示为CO2+H2===H2O(g)+CO
c.CO未参与反应
d.Fe3O4、CaO为催化剂,降低了反应的ΔH
②其他条件不变,在不同催化剂(Ⅰ、Ⅱ、Ⅲ)作用下,反应CH4(g)+CO2(g)===2CO(g)+2H2(g)进行相同时间后,CH4的转化率随反应温度的变化如图所示。a点所代表的状态________(填“是”或“不是”)平衡状态;b点CH4的转化率高于c点,原因是____________________________________________________________。

(2)在一刚性密闭容器中,CH4和CO2的分压分别为20 kPa、25 kPa,加入Ni/α-Al2O3催化剂并加热至1 123 K使其发生反应CH4(g)+CO2(g) ![]() 2CO(g)+2H2(g)。
2CO(g)+2H2(g)。
①研究表明CO的生成速率v(CO)=1.3×10-2·p(CH4)·p(CO2) mol·g-1·s-1,某时刻测得p(CO)=20 kPa,则p(CO2)=________kPa,v(CO)=________mol·g-1·s-1。
②达到平衡后测得体系压强是起始时的1.8倍,则该反应的平衡常数的计算式为Kp=________(kPa)2。(用各物质的分压代替物质的量浓度计算)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】0.1 mol·L-1Na2S2O3溶液和0.1 mol·L-1H2SO4溶液各5 mL,与10 mL水混合,反应速率为v1mol·L-1·s-1;0.2 mol·L-1Na2S2O3溶液和0.2 mol·L-1H2SO4溶液各5 mL,与20 mL水混合,反应速率为v2mol·L-1·s-1。则v1和v2的关系是( )
A.v1>v2
B.v1<v2
C.v1=v2
D.不能肯定
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com