
 桃李文化快乐暑假武汉出版社系列答案
桃李文化快乐暑假武汉出版社系列答案 优秀生快乐假期每一天全新寒假作业本系列答案
优秀生快乐假期每一天全新寒假作业本系列答案 暑假接力赛新疆青少年出版社系列答案
暑假接力赛新疆青少年出版社系列答案科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| 元素 | X | Y | |
| 电离能/kJ?mol-1 | I1 | 762 | 717 |
| I2 | 1561 | 1509 | |
| I3 | 2957 | 3248 | |
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
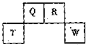 (2012?长宁区一模)短周期元素Q、R、T、W在元素周期表中的位置如图所示,其中T所处的周期序数与主族序数相等,请回答下列问题:
(2012?长宁区一模)短周期元素Q、R、T、W在元素周期表中的位置如图所示,其中T所处的周期序数与主族序数相等,请回答下列问题:

| ||
| ||
| ||
| ||
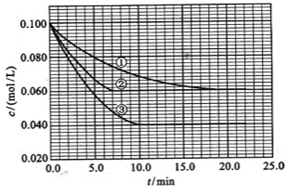
查看答案和解析>>
科目:高中化学 来源: 题型:
A.18O 31P 118Sn B.27Al 19F 12C
C.元素周期表中ⅤA族所有元素的原子 D.元素周期表中第1周期所有元素的原子
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com