
【题目】在如图所示的装置中,烧瓶中充满干燥气体a,将滴管中的液体b挤入烧瓶内,轻轻振荡烧瓶,然后打开弹簧夹f,烧杯中的液体d呈喷泉状喷出,最终几乎充满烧瓶。则a和b分别是
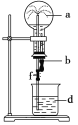
a(干燥气体) | b(液体) | |
A | NO | 水 |
B | CO2 | 4 mol/L NaHCO3溶液 |
C | Cl2 | 饱和NaCl水溶液 |
D | NH3 | 1 mol/L盐酸 |
A. AB. BC. CD. D
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E是五种短周期元素。已知:它们的原子序数依次增大,A是元素周期表中原子半径最小的元素;B原子最外层电子数比其次外层电子数多2,C是E的邻族元素;D和E的原子序数之和为30,且D的族序数与周期数相等。甲、乙、丙、丁是它们两两形成的化合物,其中甲分子中含有18个电子。
物质组成 | 甲 | 乙 | 丙 | 丁 |
化合物中各元素 原子个数比 | A和C 1:1 | B和A 1:4 | D和E 1:3 | B和E 1:4 |
请回答下列问题:
(1)若元素E的某种核素中中子数比质子数多3个,表示这种核素的符号为____________;
(2)把D的单质放到NaOH溶液中,反应的离子方程式为:_______________________;
(3)用电子式表示甲的形成过程:_____________________________________________;
(4)在密闭容器中充入BC2、BC和乙的混合气体共mg,若加入足量Na2O2,并不断用电火花点燃至反应完全,测得固体质量增重mg,则BC2与乙的质量比为________________;
(5)有100mL MgCl2和丙的混合溶液,其中c(Mg2+)= 0.2 mol· L-1,c(Cl-)= 1.3mol·L-1,要使Mg2+全部转化为沉淀分离出来,至少需要4 mol·L-1 NaOH 溶液的体积是:____________mL。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有一瓶澄清的溶液,其中可能含有 H+、NH4+、Na+、Al3+、Fe3+、I-、NO3- 、CO32-、SO42- 、AlO2-。取该溶液进行以下实验:
①用pH试纸检验,溶液呈强酸性。
②取溶液适量,加入少量CCl4和数滴新制氯水,振荡,CCl4层呈紫红色。
③该溶液的焰色反应没有黄色;
④当向该溶液中加入某浓度的NaOH溶液时,发现生成沉淀的物质的量随NaOH溶液的体积变化如图所示。
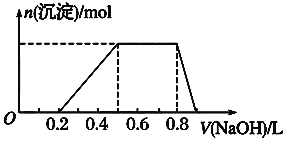
(1)该溶液中肯定含有的离子是_________________________,已确定阳离子的物质的量之比为_______________________。
(2)肯定不含的离子是_________________________________。
(3)不能确定的离子是_________,如何证明该离子是否存在?__________。
(4)请写出沉淀溶解过程的离子方程式____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质性质的变化规律,与共价键的键能大小有关的是( )
A. ![]() 、
、![]() 、
、![]() 、
、![]() 的熔点、沸点逐渐升高
的熔点、沸点逐渐升高
B. ![]() 的沸点高于
的沸点高于![]()
C. 金刚石的硬度、熔点、沸点都高于晶体硅
D. ![]() 、
、![]() 、
、![]() 、
、![]() 的熔点依次降低
的熔点依次降低
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列变化属于吸热反应的是
①用镁条引燃铝、氧化铁混合粉末 ②碳酸钙受热分解 ③浓硫酸稀释
④氢氧化钡晶体和氯化铵固体反应 ⑤生石灰和水反应
A. ②④B. ①④C. ②③D. ①⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据所学知识回答下列问题。
(1)纳米技术制成的金属燃料、非金属固体燃料、氢气等已应用到社会生活和高科技领域.单位质量的![]() 和
和![]() 单质燃烧时均放出大量热,可用作燃料.已知
单质燃烧时均放出大量热,可用作燃料.已知![]() 和
和![]() 为短周期元素,其原子的第一至第四电离能如下表所示:
为短周期元素,其原子的第一至第四电离能如下表所示:
电离能/ |
|
|
|
|
| 932 | 1821 | 15390 | 21771 |
| 738 | 1451 | 7733 | 10540 |
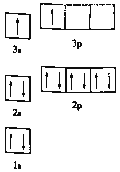
①某同学根据上述信息,推断![]() 的核外电子排布如图所示,该同学所画的电子排布图违背了_________,
的核外电子排布如图所示,该同学所画的电子排布图违背了_________, ![]() 元素位于周期表五个区域中的___ 区。
元素位于周期表五个区域中的___ 区。
②![]() 分子的中心原子
分子的中心原子![]() 采取_________杂化,
采取_________杂化, ![]() 的空间构型为___ 。
的空间构型为___ 。
(2)![]() 原子或离子外围有较多能量相近的空轨道,所以其能与一些分子或离子形成配合物。
原子或离子外围有较多能量相近的空轨道,所以其能与一些分子或离子形成配合物。
① 与![]() 原子或离子形成配合物的分子或离子应具备的结构特征是____。
原子或离子形成配合物的分子或离子应具备的结构特征是____。
② 六氰合亚铁离子![]() 中不存在____________(填字母)。
中不存在____________(填字母)。
A.共价键 B.非极性键 C.配位键 D. ![]() 键
键
写出一种与![]() 互为等电子体的单质的分子式:________________ 。
互为等电子体的单质的分子式:________________ 。
(3)—种![]() 合金的晶胞结构如图,请据此回答下列问题:
合金的晶胞结构如图,请据此回答下列问题:
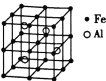
① 该合金的化学式为____________。
② 若晶体的密度为![]()
![]() ,则该晶胞棱长为____________
,则该晶胞棱长为____________![]() (设
(设![]() 为阿伏加德罗常数的值,用含
为阿伏加德罗常数的值,用含![]() 和
和![]() 的代数式表示,不必化简)。
的代数式表示,不必化简)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,向20 mL 0.2 mol·L-1 H2A溶液中滴加0.2 mol·L-1NaOH溶液。有关微粒物质的量变化如下图(其中Ⅰ代表H2A,Ⅱ代表HA-,Ⅲ代表A2-)。根据图示判断,下列说法正确的是( )

A. H2A在水中的电离方程式是:H2A===H++HA-、HA-![]() H++A2-
H++A2-
B. 等体积等浓度的NaOH溶液与H2A溶液混合后溶液显碱性
C. 当V(NaOH)=20 mL时,溶液中存在以下关系:c(H+)+c(H2A)=c(A2-)+c(OH-)
D. 当V(NaOH)=30 mL时,溶液中各粒子浓度的大小顺序为:c(Na+)>c(HA-)>c(A2-)>c(H+)>c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:pKa=-lgKa,25 ℃时,H2SO3 的 pKa1=1.85,pKa2=7.19。常温下,用 0.1 mol·L-1NaOH 溶液滴定 20 mL0.1 mol·L-1H2SO3 溶液的滴定曲线如右图所示。 下列说法不正确的是( )

A. a 点所得溶液中:c(HSO3-)=c(H2SO3)
B. b 点所得溶液中:c(H2SO3)+c(H+)=c(SO32-)+c(OH-)
C. c 点所得溶液中:c(Na+)=3c(HSO3-)
D. d 点所得溶液中:c(Na+)>c(SO32-)>c(OH-)>c(HSO3-)>c(H+)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com