
常温下,下列各组离子在指定溶液中能大量共存的是( )
A.pH=1的溶液中:Fe2+、NO 、SO
、SO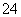 、Na+
、Na+
B.水电离出的c(H+)=10-12 mol/L的溶液中:Ca2+、K+、Cl-、HCO
C.c(H+)/c(OH-)=1012的水溶液中:NH 、Al3+、NO
、Al3+、NO 、Cl-
、Cl-
D.c(Fe3+)=0.1 mol/L的溶液中:K+、ClO-、SO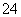 、SCN-
、SCN-
 一诺书业暑假作业快乐假期云南美术出版社系列答案
一诺书业暑假作业快乐假期云南美术出版社系列答案科目:高中化学 来源: 题型:
向一定量Fe、FeO、Fe2O3的混合物中,加入50mL 1mol/L硫酸,恰好使混合物完全溶解,放出224mL(标准状况)的气体,所得溶液中加入KSCN溶液无血红色出现。若用足量的CO在高温下还原相同质量的混合物,能得到铁的质量为
A.11.2g B.5.6g C.2.8g D.无法计算
查看答案和解析>>
科目:高中化学 来源: 题型:
有甲、乙两个相同的恒容密闭容器,体积均为0.25 L,在相同温度下均发生可逆反应:X2(g)+3Y2(g)2XY3(g) ΔH=-92.6 kJ·mol-1。实验测得起始、平衡时的有关数据如表所示:
| 容器编号 | 起始时各物质的物质的量/mol | 平衡时体系 能量的变化 | ||
| X2 |
| XY3 | ||
| 甲 | 1 | 3 | 0 | 放出热量:23.15 kJ |
| 乙 | 0.9 | 2.7 | 0.2 | 放出热量:Q |
下列叙述错误的是( )
A.若容器甲体积为0.5 L,则平衡时放出的热量小于23.15 kJ
B.容器乙中达平衡时放出的热量Q=23.15 kJ
C.容器甲、乙中反应的平衡常数相等
D.平衡时,两个容器中XY3的体积分数均为1/7
查看答案和解析>>
科目:高中化学 来源: 题型:
常温下,将一定浓度的盐酸和醋酸加水稀释,溶液的导电能力随溶液体积变化的曲线如图所示。判断下列说法中,正确的是( )
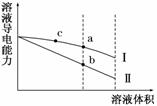
A.两溶液稀释前的浓度相同
B.a、b、c三点溶液的p H由大到小顺序为a>b>c
H由大到小顺序为a>b>c
C.a点的KW值和b点的KW相等
D.a点水电离的c(H+)大于c点水电离的c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
(1)在25℃时,向浓度均为0.01 mol·L-1的MgCl2和AlCl3混合溶液中逐滴加入氨水,先生成________沉淀(填化学式),生成该沉淀的离子 方程式为_____________________。
方程式为_____________________。
(已知25℃时Ksp[Mg(OH)2]=1.8×10-11,
Ksp[Al(OH)3]=3×10-34。)
(2)某温度(t℃)时,测得0.01 mol·L-1的NaOH溶液的pH=11。在此温度下,将pH=2的H2SO4溶液VaL与pH=12的NaOH溶液VbL混合,若所得混合液为中性,则Va︰Vb=________。
(3)在25℃时,将c mol·L-1的醋酸溶液与0.02 mol·L-1NaOH溶液等体积混合后溶液刚好呈中性,用含c的代数式表示CH3COOH的电离常数Ka=________。
(4)(2013·山东高考)25℃时,H2SO3HSO +H+的电离常数Ka=1×10-2mol·L-1,则该温度下NaHSO3水解反应的平衡常数Kb=________mol·L-1,若向NaHSO3溶液中加入少量的I2,则溶液中
+H+的电离常数Ka=1×10-2mol·L-1,则该温度下NaHSO3水解反应的平衡常数Kb=________mol·L-1,若向NaHSO3溶液中加入少量的I2,则溶液中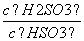 将________(填“增大”、“减小”或“不变”)。
将________(填“增大”、“减小”或“不变”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
化工生产中含Cu2+的废水常用MnS(s)作沉淀剂,其反应原理为Cu2+(aq)+MnS(s)CuS(s)+Mn2+(aq)。下列有关该反应的推理不正确的是( )
A.该反应达到平衡时:c(Cu2+)=c(Mn2+)
B.CuS的溶解度比MnS的溶解度小
C.往平衡体系中加入少量Cu(NO3)2(s)后,c(Mn2+)变大
D.该反应平衡常数表达式:K=
查看答案和解析>>
科目:高中化学 来源: 题型:
下列分离或除杂的方法不正确的是
( )
A.用分液法分离水和酒精
B.用蒸馏法分离苯和溴苯
C.用重结晶方法提纯苯甲酸
D.用饱和碳酸氢钠溶液除去二氧化碳中混有的少量氯化氢气体
查看答案和解析>>
科目:高中化学 来源: 题型:
甲醛在医药、染料、香料等行业中都有着广泛的应用。实验室通过下图所示的流程由甲苯氧化制备苯甲醛,试回答下列问题。
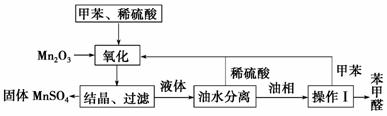
(1)Mn2O3氧化甲苯的反应需要不断搅拌,搅拌的作用是__________________
______________________________________________________。
(2)甲苯经氧化后得到的混合物通过结晶、过滤进行分离,该过程中需将混合物冷却,其目的是________________________________________________
________________________。
(3)实验过程中,可循环使用的物质有________、________。
(4)实验中分离甲苯和苯甲醛采用的操作Ⅰ是______,其原理是__________
______________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
某有机物的结构简式: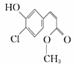 ,下列关于该有机物的叙述正确的是
,下列关于该有机物的叙述正确的是
A.该有机物的摩尔质量为200.5
B.该有机物属于芳香烃
C.该有机物可发生取代、加成、加聚、氧化、还原、消去反应
D.1 mol该有机物在适当条件下,最多可与4 mol NaOH、4 mol H2反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com