
| A. | 碳的燃烧热是110.5 kJ•mol-1 | |
| B. | 碳的燃烧热是221 kJ•mol-1 | |
| C. | 稀硫酸与稀NaOH溶液反应的中和热为57.3kJ•mol-1 | |
| D. | 浓硫酸与稀NaOH溶液反应生成1mol水,放出57.3kJ热量 |
分析 A.燃烧热是指1mol纯净物完全燃烧生成稳定的氧化物放出的热量,生成稳定的氧化物,水应为液态;
B.燃烧热是指1mol纯净物完全燃烧生成稳定的氧化物放出的热量,生成稳定的氧化物,水应为液态;
C.中和热为57.3kJ•mol-1;
D.浓硫酸溶解过程为放热过程.
解答 解:A.燃烧热是指1mol纯净物完全燃烧生成稳定的氧化物放出的热量,生成稳定的氧化物,则C燃烧生成二氧化碳,故A错误;
B.燃烧热是指1mol纯净物完全燃烧生成稳定的氧化物放出的热量,生成稳定的氧化物,则C燃烧生成二氧化碳,故B错误;
C.已知中和热为放热反应,则叙述中和热时不用“-”,即稀硫酸与稀NaOH溶液反应的中和热为57.3kJ•mol-1,故C正确;
D.浓硫酸溶解过程为放热,则浓硫酸与稀NaOH溶液反应生成1mol水,放出热量大于57.3kJ,故D错误.
故选C.
点评 本题考查燃烧热和中和热的理解,题目难度不大,易错点为C,注意中和热的表示方法.


科目:高中化学 来源: 题型:解答题
| 物质 | H2 | CO | C H3O H |
| 浓度/(mol•L-1) | 0.2 | 0.2 | 0.4 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
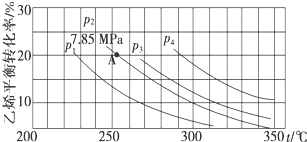
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氧化剂本身被还原,具有氧化性;还原剂本身被氧化,具有还原性 | |
| B. | 有单质参加或生成的反应一定属于氧化还原反应 | |
| C. | 失电子难的原子,获得电子的能力一定强 | |
| D. | 在氧化还原反应中,肯定有一种元素被氧化,另一种元素被还原 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 碳酸钠溶液跟足量稀H2SO4混合:CO32-+2H+═H2O+CO2↑ | |
| B. | 硝酸铜溶液中滴加烧碱溶液:Cu2++2OH-═Cu(OH)2↓ | |
| C. | 次氯酸溶液中加入氢氧化钾溶液:H++OH-═H2O | |
| D. | 碳酸钙溶于醋酸CaCO3+2CH3COOH═Ca2++2CH3COO-+H2O+CO2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
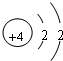 ,B原子的电子式
,B原子的电子式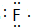 ,C的离子结构示意图
,C的离子结构示意图 ,B与D所形成的化合物的电子式
,B与D所形成的化合物的电子式 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| CO2 | H2 | CO | H2O | |
| 甲 | amol | amol | 0mol | 0mol |
| 乙 | 2amol | 2amol | 0mol | 0mol |
| 丙 | 2amol | 2amol | amol | amol |
| 丁 | amol | 0mol | 2amol | 2amol |
| A. | 丙>丁>乙>甲 | B. | 丙>乙=丁>甲 | C. | 丙>乙>甲>丁 | D. | 乙=丙>甲>丁 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com