
�����»�ѧ��Ӧ��2A��g����B��g�� 2C��g������H<0��
2C��g������H<0��
��1������4 mol A��2 mol B��2 L�������л�ϣ���2 s����C��Ũ��Ϊ0��6 mol/L��������A��ʾ��ƽ����Ӧ����Ϊ_____��2sʱ����B��Ũ��Ϊ__________��
��2������4 mol A��2 mol B�����������������У�һ���¶��´ﵽƽ��״̬��������������ʵ���Ϊ4��2 mol����ʱ�����������C���������Ϊ__________������ͨ������B���壬��ϵ��A�����ʵ���_________�����������С�����䡱������ҪʹA�����ʵ����ٴﵽ��ԭƽ��״̬��ͬ���ɲ�ȡ�����ִ�ʩ�� �� ��

| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ��2016��ӱ�ʡ������ѧ�����в��Ի�ѧ�Ծ��������棩 ���ͣ�ѡ����
ijϡ��Һ�к���Fe(NO3)3 ��Cu(NO3)2��HNO3���������������ۣ���Һ��Fe2+Ũ�Ⱥͼ������۵����ʵ���֮��Ĺ�ϵ��ͼ��ʾ������Һ��Fe(NO3)3��Cu(NO3)2��HNO3���ʵ���Ũ��֮��Ϊ

A�� 1:1:4 B��1:3:1 C��3:3:8 D��1:1:1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2015-2016ѧ�����ʡ�ڵ�������ѧУ�߶���ѧ�����в��Ի�ѧ�Ծ��������棩 ���ͣ�?????
���������У�������ֱ�Ӽ��ȵ���
A����Ͳ B������ƿ C���Թ� D���ձ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2015-2016ѧ�꽭��ʡ��ʿ���ɻ���ɽ����У��һ������������ѧ�Ծ��������棩 ���ͣ�ѡ����
����˵������ȷ����
A��O2��Ħ��������32g
B������������һ���ǽ������������������һ���Ƿǽ���������
C��̼������Һ��ʹ��̪��Һ��죬������Ǽ�
D����Ȼ������̼����ˮ�ܵ��磬�����Ƿǵ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2015-2016ѧ�꽭����һ���鶼��������ѧ�ȸ�һ������������ѧ�Ծ��������棩 ���ͣ�ѡ����
���˺��ʳ��ˮ�Ժ��п����Ե�CaCl2��MgCl2��Na2SO4�����ʣ�ͨ�����¼���ʵ�鲽�裬���Ƶô�����ʳ��ˮ���ټ����Թ�����Na2CO3��Һ���ڼ����Թ�����NaOH��Һ���ۼ����Թ�����BaCl2��Һ���ܵ���ϡ�����������ݲ������ݹ��ˡ���ȷ�IJ���˳����
A���ۢڢ٢ݢ� B���ۢݢڢ٢� C���ڢۢ٢ܢ� D�� �٢ڢۢݢ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2015-2016ѧ���㽭ʡ��һ��10���¿���ѧ�Ծ��������棩 ���ͣ�������
��̬ũҵ�漰ũ�ҷ��ϵ��ۺ����á�ij�ַ��Ͼ����͵õ�һ�ֺ��м��顢������̼�������Ļ������8.96L����״������������ͨ��ʢ�к�ɫCuO��ĩ��Ӳ�ʲ����ܣ������ķ�ӦΪ��CH4��4CuO  CO2����2H2O����4Cu����������ȫ��Ӧ��Ӳ�ʲ����ܵ�����������4.8g������Ӧ������ͨ��2L 0.1mol/L�ij���Ca(OH)2��Һ��������գ����ɳ���10g��
CO2����2H2O����4Cu����������ȫ��Ӧ��Ӳ�ʲ����ܵ�����������4.8g������Ӧ������ͨ��2L 0.1mol/L�ij���Ca(OH)2��Һ��������գ����ɳ���10g��
��1��ԭ�����������ʵ����� �����ɳ�����Ħ�������� ��
��2��ԭ��������м��������� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2016��ɽ��ʡ������ѧ�����нβ��Ի�ѧ�Ծ��������棩 ���ͣ�ѡ����
��Al��CuO��Fe2O3��ɵĻ���ﹲ10.0 g������500 mLijŨ�ȵ������У��������ȫ�ܽ⣬���ټ���250 mL 2.00 mol��L��1��NaOH��Һʱ���õ�������ࡣ���������Ũ��Ϊ
A��1.00 mol��L��1 B��0.500 mol��L��1 C��2.00 mol��L��1 D��3.00 mol��L��1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2015-2016ѧ�긣��ʡ�ĵ���У�߶���ѧ��11��������ѧ�Ծ��������棩 ���ͣ�ѡ����
�״����ӽ���Ĥȼ�ϵ���н��״�����ת��Ϊ���������ַ�Ӧԭ����
��CH3OH(g)+H2O(g)=CO2(g)+3H2(g)�� ��H1= + 49��0 kJ��mol��1
��CH3OH(g)+1/2O2(g)=CO2(g)+2H2(g)����H2=��192��9 kJ��mol��1
����˵����ȷ����
A��CH3OH(g)+3/2O2(g)=CO2(g)+2H2O(g) ���ʱ��H = 3��H2 + 2��H1
B.Ӧ���е������仯��ͼ��ʾ
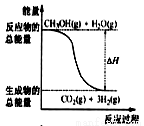
C��CH3OHת���H2�Ĺ���һ��Ҫ��������
D�����ݢ���֪��Ӧ��CH3OH(l)+1/2O2(g)=CO2(g)+2H2(g)�ġ�H>��192��9kJ��mol��1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2015-2016ѧ��ɽ��ʡ�߶���ѧ�����в��Ի�ѧ�Ծ��������棩 ���ͣ�ѡ����
�����裨Si3N4����һ�������մɲ��ϣ�������ʯӢ�뽹̿�ڸ��µĵ������У�ͨ�����·�Ӧ�Ƶã�3SiO2+6C+2N2 Si3N4+6CO��������������ȷ����
Si3N4+6CO��������������ȷ����
A������֪������ӦΪ���ȷ�Ӧ�������¶ȣ���ƽ�ⳣ����С
B��������Ӧ��ÿ����1molSi3N4 ��ת��12mol����
��ת��12mol����
C���ڵ�����ĺϳɷ�Ӧ�У�N2����������SiO2�ǻ�ԭ��
D����ʹѹǿ��������ƽ�����淴Ӧ�����ƶ�
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com