
分析 原子序数小于18的X、Y、Z三种元素,其中X是形成化合物最多的元素,则X是氢元素;Y原子基态时最外层电子数是其内层电子数的2倍,原子最外层电子数不超过8个,所以其内层为K层,则Y是C元素;Z原子基态时2p原子轨道上有3个未成对的电子,则Z是N元素,据此解答即可.
解答 解:依据分析可知:X为氢、Y为碳、Z为氮,
(1)X为氢、Y为碳,故答案为:氢;碳;
(2)C2H2分子中每个C原子含有2个σ键,所以C轨道的杂化类型为sp杂化,一个乙炔分子中含有3个σ键,则1mol C2H2含有σ键的数目为3NA,故答案为:sp杂化;3NA;
(3)氨气中价层电子对个数=3+$\frac{1}{2}$(5-3×1)=4且含有1个孤电子对,所以N原子采用sp3杂化,故答案为:sp3杂化;
(4)元素C的一种氧化物与元素N的一种氧化物互为等电子体,CO2和N2O互为等电子体,所以元素Z的这种氧化物的分子式是N2O,故答案为:N2O.
点评 本题考查了元素位置结构性质的相互关系及应用,涉及氢键、原子杂化方式的判断等知识点,这些知识点都是考试热点,灵活运用基本知识来分析解答,题目难度不大.


 课堂全解字词句段篇章系列答案
课堂全解字词句段篇章系列答案 步步高口算题卡系列答案
步步高口算题卡系列答案 点睛新教材全能解读系列答案
点睛新教材全能解读系列答案科目:高中化学 来源: 题型:选择题
| A. | 甲烷与乙烷体积比是1:4 | B. | 丙炔与乙炔体积比是1:4 | ||
| C. | 乙烯与丁烷体积比是1:4 | D. | 乙烯与丁烯体积比是1:4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 元素周期表中元素种类最多的周期是第6周期 | |
| B. | 第IA族元素均为碱金属元素 | |
| C. | 原子最外层电子数为2的元素一定位于第ⅡA族 | |
| D. | 元素周期表中元素种类最多的族是第Ⅷ族 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
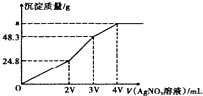 某混合溶液中含有溶质为NaCl、KI和Na2S各0.1mol,往该溶液在加入一定浓度的AgNO3溶液,产生沉淀的质量随加入AgNO3溶液的体积变化如图所示,则下列说法中不正确的是( )
某混合溶液中含有溶质为NaCl、KI和Na2S各0.1mol,往该溶液在加入一定浓度的AgNO3溶液,产生沉淀的质量随加入AgNO3溶液的体积变化如图所示,则下列说法中不正确的是( )| A. | 所加AgNO3溶液的物质的量浓度为$\frac{0.1}{V}mol•{L}^{-1}$ | |
| B. | a的数值为62.65 | |
| C. | 常温下,AgCl,AgI,AgS在水中溶解能力依次减小 | |
| D. | 在AgCl饱和溶液中加入NaI固体,有AgI沉淀生成 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 5mol | B. | 4mol | C. | 3mol | D. | 2mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 反应前5 s内,用NO表示的平均反应速率为0.1 mol•L-1•S-1 | |
| B. | 达到平衡后,CO2的浓度与CO的浓度不同 | |
| C. | 当v正(CO)=2v逆(N2)时反应达到平衡 | |
| D. | 达到平衡后,升高温度,正反应速率将减小,逆反应速率将增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
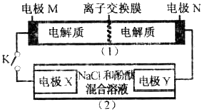 如图装置(1)为一种可充电电池的示意图,其中的离子交换膜只允许K+通过,该电池充、放电的化学方程式为2K2S2+KI3$?_{放电}^{充电}$K2S4+3KI.
如图装置(1)为一种可充电电池的示意图,其中的离子交换膜只允许K+通过,该电池充、放电的化学方程式为2K2S2+KI3$?_{放电}^{充电}$K2S4+3KI.| A. | K+从右到左通过离子交换膜 | |
| B. | 电极M的反应式:I3-+2e-=3I- | |
| C. | 电极X的反应式:4OH--4e-═O2↑+2H2O | |
| D. | 当电极Y有0.2mole-转移时,产生0.1molCl2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com