
已知:可逆反应2SO2(g)+O2(g)  2SO3(g) ΔH<0,在一定条件下达到平衡后,改变下列条件一定能使该平衡向正反应方向移动的是( )
2SO3(g) ΔH<0,在一定条件下达到平衡后,改变下列条件一定能使该平衡向正反应方向移动的是( )
A.升温增压 B.降温增压
C.升温减压 D.降温减压
科目:高中化学 来源: 题型:
下列溶液中,溶质的物质的量浓度为1 mol·L-1的是
A.将40 g NaOH溶于1 L水所得的溶液
B.将80 g SO3溶于水并配成1 L的溶液
C.将0.5 mol·L-1的NaNO3溶液100 mL加热蒸发掉50 g水的溶液
D.含K+为2 mol的K2S O4溶液
O4溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
氢氧化铜是一种常用试剂,例如利用新制的氢氧化铜悬浊液验证葡萄糖的还原性。
Ⅰ.新制氢氧化铜悬浊液的配制和应用:
(1)实验室制取氢氧化铜悬浊液的操作方法:在试管中加入10%的溶液2mL,滴入2%的溶液4~5滴(填“硫酸铜”或“氢氧化钠”),振荡即可,这样操作的目的是____________________。
(2)下列各组物质的溶液仅用新制的氢氧化铜悬浊液(可以加热)不能鉴别开来的是。
A.HCOOH、C6H5COOH、C6H5CH2OH
B.NaHSO4、BaCl2、Na2CO3、酚酞
C.HCOOH、HCOONa、HCOOCH3
D.葡萄糖、C6H14O6
下面是三个研究性学习小组分别从不同层面开展研究性学习活动:
Ⅱ.研究性学习小组甲,为了探究新制氢氧化铜悬浊液与久置氢氧化铜氧化性的差异,利用乙醛作还原剂,他们设计的方案是:取编号为X、Y的两支试管,分别装入一定量的新制氢氧化铜悬浊液和氢氧化铜沉淀,再分别加入3mL乙醛溶液,同时用水浴加热几分钟,结果X试管里出现砖红色沉淀,而Y试管出现黑色物质。你认为可能的原因是________________________________。
Ⅲ.研究性学习小组乙对教材中实验结论“乙醛与新制的氢氧化铜悬浊液反应生成的红色沉淀是Cu2O”提出质疑,他们认为红色沉淀不一定是氧化亚铜。为了确定红色沉淀的成分,小组进行如下研究:
提出猜想:________________________________。
查阅资料:①氧化亚铜属于碱性氧化物;②+1价的铜离子在酸性条件下易发生自身氧化还原反应;③在空气中灼烧氧化亚铜生成氧化铜。
设计方案:
方案1:取该红色沉淀溶于足量的稀硝酸中,观察溶液颜色变化
方案2:取该红色沉淀溶于足量的稀硫酸中,观察是否有残渣
方案3:称取红色沉淀a g,在空气中充分灼烧至完全变黑,并在干燥器中冷却,再称量,反复多次直至固体恒重,称得质量为b g,比较a、b关系
方案4:取红色沉淀装入试管里,加入酸化的硝酸银溶液,观察是否有银白色的银析出
你认为合理的方案是。
Ⅳ.研究性学习小组丙设计新方案,装置如下图所示。你认为要测定红色沉淀的成分必须测定下列哪些物理量。
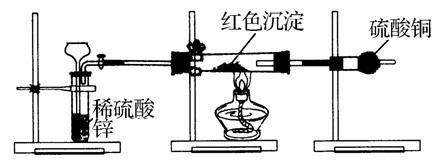
①通入氢气的体积;②反应前,红色沉淀+硬质试管的总质量;③完全反应后,固体+硬质试管的总质量;④反应前,干燥管质量;⑤硬质试管质量;⑥锌粒质量;⑦稀硫酸中含溶质质量;⑧反应后,干燥管质量。
查看答案和解析>>
科目:高中化学 来源: 题型:
Na2O2、HCl、Al2O3三种物质在水中完全反应后,溶液中只含有Na+、H+、Cl—、OH—;且溶液呈中性,则Na2O2、HCl、Al2O3的物质的量之比可能为
A.3︰2︰1 B. 2︰4︰1 C. 2︰3︰1 D.4︰2︰1
查看答案和解析>>
科目:高中化学 来源: 题型:
(1)在反应2KMnO4+16HBr===5Br2+2MnBr2+2KBr+8H2O中,还原剂是___▲___还原产物是___▲____。
(2) 该反应中,发生氧化反应的过程是___▲____→___▲____。
(3) 若有0.1 mol KMn04 参加反应,则转移电子的物质的量为 ___▲____mol, 被氧化的HBr的物质的量为 ___▲____ mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
一定条件下,在恒容密闭容器中,能表示反应X(g)+2Y(g)  2Z(g)一定达到化学平衡状态的是( )
2Z(g)一定达到化学平衡状态的是( )
①X、Y、Z的物质的量之比为1∶2∶2
②X、Y、Z的浓度不再发生变化
③容器中的压强不再发生变化
④单位时间内生成n mol Z,同时生成2n mol Y
A.①② B.①④
C.②③ D.③④
查看答案和解析>>
科目:高中化学 来源: 题型:
密闭容器中一定量的混合气体发生反应:xA(g)+yB(g)  zC(g)
zC(g) ,平衡时,测得A的浓度为0.50 mol/L,在温度不变时,把容器容积扩大到原来的2倍,使其重新达到平衡,A的浓度为0.30 mol/L,有关叙述不正确的是( )
,平衡时,测得A的浓度为0.50 mol/L,在温度不变时,把容器容积扩大到原来的2倍,使其重新达到平衡,A的浓度为0.30 mol/L,有关叙述不正确的是( )
A.平衡一定向右移动 B.B的转化率升高
C.x+y>z  D.C的体积分数降低
D.C的体积分数降低
查看答案和解析>>
科目:高中化学 来源: 题型:
能正确表示下列反应的离子方程式为
A.碳酸氢钠溶液中滴入氢氧化钙溶液:
HCO +
+ OH-===CO
OH-===CO +H2O
+H2O
B.二氧化硫通入次氯酸钠溶液:
SO2+2ClO-===SO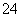 +2Cl-
+2Cl-
C.硫化钡加入稀硫酸:
BaS+2H+===H2S↑+Ba2+
D.新制的氧化铝可溶于氢氧化钠溶液:
Al2O3+2OH-===2AlO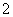 +H2O
+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
高炉炼铁过程中发生的主要反应为
 Fe2O3(s)+CO(g)
Fe2O3(s)+CO(g) 
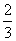 Fe(s)+CO2(g)。已知该反应在不同温度下的平衡常数如下:
Fe(s)+CO2(g)。已知该反应在不同温度下的平衡常数如下:
| 温度/℃ | 1 000 | 1 150 | 1 300 |
| 平衡常数 | 4.0 | 3.7 | 3.5 |
请回答下列问题:
(1)该反应的平衡常数表达式K=________,ΔH________0(填“>”、“<”或“=”);
(2)在一个容积为10 L的密闭容器中,1 000℃时加入Fe、Fe2O3、CO、CO2各1.0 mol,反应经过10 min后达到平衡。求该时间范围内反应的平均反应速率v(CO2)=________,CO的平衡转化率=________;
(3)欲提高(2)中CO的平衡转化率,可采取的措施是________。
A.减少Fe的量 B.增加Fe2O3的量
C.移出部分CO2 D.提高反应温度
E.减小容器的容积 F.加入合适的催化剂
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com