
 某模拟“人工树叶”电化学实验装置如图所示,该装置能将H2O和CO2转化为O2和燃料(C3H8O).下列说法正确的是( )
某模拟“人工树叶”电化学实验装置如图所示,该装置能将H2O和CO2转化为O2和燃料(C3H8O).下列说法正确的是( )| A. | a电极的反应为:3CO2+18H++18e-=C3H8O+5H2O | |
| B. | 该装置工作时,H+从b极区向a极区迁移 | |
| C. | 每生成1molO2,有44gCO2被还原 | |
| D. | 该装置将化学能转化为光能和电能 |
分析 A、a与电源负极相连,所以a是负极阴极,电极反应式为:3CO2+18H++18e-=C3H8O+5H2O;
B、与电源正极相连的是电解池的阳极,负极相连的是电解池的阴极,a与电源负极相连,所以a是阴极,而电解池中氢离子向阴极移动;
C、电池总的方程式为:6CO2+8H2O$\frac{\underline{\;通电\;}}{\;}$2C3H8O+9O2,即生成9mol的氧气,阴极有6mol的二氧化碳被还原,由此分析解答;
D、该装置是电解池装置,是将电能转化为化学能.
解答 解:A、a与电源负极相连,所以a是阴极,发生还原反应,电极反应式为:3CO2+18H++18e-=C3H8O+5H2O,故A错误;
B、a与电源负极相连,所以a是阴极,而电解池中氢离子向阴极移动,所以H+从阳极b极区向阴极a极区迁移,故B正确;
C、电池总的方程式为:6CO2+8H2O$\frac{\underline{\;通电\;}}{\;}$2C3H8O+9O2,即生成9mol的氧气,阴极有6mol的二氧化碳被还原,也就是1mol的氧气,阴极有$\frac{2}{3}$mol的二氧化碳被还原,所以被还原的二氧化碳为29.3g,故C错误;
D、该装置是电解池装置,是将电能转化为化学能,所以该装置将光能和电能转化为化学能,故D错误;
故选B.
点评 本题考查电化学的相关知识,学生要清楚电解池的反应原理,阴极发生还原反应,阳极发生氧化反应,以及离子的移动方向就可以迅速解题了,比较容易.


科目:高中化学 来源: 题型:解答题
| Ka1 | Ka2 | |
| H2SO3 | 1.3×10-2 | 6.3×10-8 |
| H2CO3 | 4.2×10-7 | 5.6×10-11 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
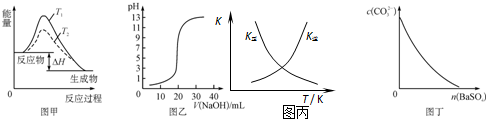
| A. | 图甲表示温度T1>T2,SO2与O2反应过程中的能量变化 | |
| B. | 图乙表示0.100 0 mol/L NaOH溶液滴定20.00 mL 0.100 0 mol/L CH3COOH溶液所得到的滴定曲线 | |
| C. | 图丙表示恒容密闭容器中反应“2SO2(g)+O2(g)?2SO3(g)△H<0”的平衡常数K正、K逆随温度的变化 | |
| D. | 图丁表示在饱和Na2CO3溶液中逐步加BaSO4固体后,溶液中c(CO32-)的浓度变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
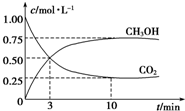 为探究用CO2来生产燃料甲醇的反应原理,现进行如下实验:在体积为1L的密闭容器中,充入1mol CO2和3molH2,一定条件下发生反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H=-49.0kJ•mol-1,T温度下,测得CO2和CH3OH(g)的浓度随时间变化如图.请回答下列问题:
为探究用CO2来生产燃料甲醇的反应原理,现进行如下实验:在体积为1L的密闭容器中,充入1mol CO2和3molH2,一定条件下发生反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H=-49.0kJ•mol-1,T温度下,测得CO2和CH3OH(g)的浓度随时间变化如图.请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 平衡前,随着反应的进行,容器内压强始终不变 | |
| B. | 平衡时,其他条件不变,分离出硫,正反应速率加快 | |
| C. | 平衡时,若升高温度,CO体积分数增大,则该反应的△H>0 | |
| D. | 其他条件不变,使用不同催化剂,该反应平衡常数不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 只具有氧化性 | B. | 只具有还原性 | ||
| C. | 既有氧化性也有还原性 | D. | 既无氧化性也无还原性 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | AgNO3、K2CO3 | B. | AgNO3、K2CO3、HNO3 | ||
| C. | K2CO3、AgNO3 | D. | K2CO3、AgNO3、HNO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 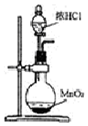 用如图装置制取氯气 | |
| B. | 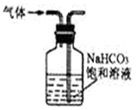 用如图装置除去CO2中的少量SO2气体 | |
| C. | 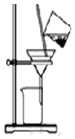 用如图装置分离饱和Na2CO3溶液中的NaHCO3晶体 | |
| D. | 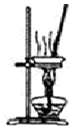 用如图装置将MgCl2.6H2O加热得到MgCl2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com