
已知25℃时部分弱电解质的电离平衡常数数据如表所示:
| 化学式 | CH3COOH | H2CO3 | HClO | |
| 电离平 衡常数 | Ka= 1.8×10-5 | Ka1= 4.3×10-7 | Ka2= 5.6×10-11 | Ka= 3.0×10-8 |
回答下列问题:
(1)物质的量浓度均为0.1 mol·L-1的四种溶液:
a.CH3COONa b.Na2CO3 c.NaClO d.NaHCO3
pH由小到大的排列顺序是 (用编号填写)。
(2)常温下,0.1 mol·L-1的CH3COOH溶液加水稀释过程中,下列表达式的数据变大的是 。
A.c(H+) B.c(H+)/c(CH3COOH)
C.c(H+)·c(OH-) D.c(OH-)/c(H+)
E.c(H+)·c(CH3COO-)/c(CH3COOH)
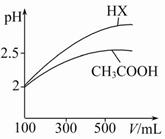
(3)体积均为100 mL pH=2的CH3COOH与一元酸HX,加水稀释过程中pH与溶液体积的关系如图所示,则HX的电离平衡常数 (填“大于”“小于”或“等于”)CH3COOH的电离平衡常数,理由是 。
【解析】(1)根据表中的电离平衡常数,可知酸性:CH3COOH>H2CO3>HClO>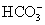 ,因此对应钠盐溶液的碱性:CH3COONa<NaHCO3<NaClO<Na2CO3。
,因此对应钠盐溶液的碱性:CH3COONa<NaHCO3<NaClO<Na2CO3。
(2)CH3COOH加水稀释,电离程度增大,n(H+)增大,但c(H+)减小,A错;由于温度不变,电离平衡常数不变,水的离子积不变,C错、E错;c(H+)/c(CH3COOH)=
Ka/c(CH3COO-),因此c(H+)/c(CH3COOH)增大,B对;c(H+)减小,而水的离子积不变,则c(OH-)增大,因此c(OH-)/c(H+)增大,D对。
答案:(1)a<d<c<b
(2)B、D
(3)大于 稀释相同倍数,一元酸HX的pH变化比CH3COOH的pH变化大,故HX酸性较强,电离平衡常数较大


 口算能手系列答案
口算能手系列答案科目:高中化学 来源: 题型:
有效地利用现有能源和开发新能源已受到各国的普 遍重视。改进汽油组成的办法可用来改善汽油的燃烧性能。例如,加入CH3OC(CH3)3来生产“无铅汽油”。CH3OC(CH3)3分子中必存在的原子间连接形式有 ( )。
遍重视。改进汽油组成的办法可用来改善汽油的燃烧性能。例如,加入CH3OC(CH3)3来生产“无铅汽油”。CH3OC(CH3)3分子中必存在的原子间连接形式有 ( )。
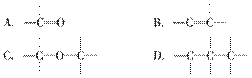
查看答案和解析>>
科目:高中化学 来源: 题型:
三氧化二镍(Ni2O3)是一种重要的电子元件材料和蓄电池材料。工业上利用含镍废料(镍、铁、钙、镁合金为主)制取草酸镍(NiC2O4·2H2O),再高温煅烧草酸镍制取三氧化二镍。已知草酸的钙、镁、镍盐均难溶于水。根据下列工艺流程示意图回答问题。
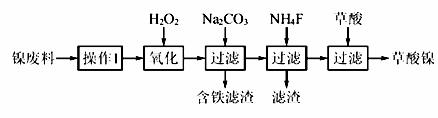
(1)操作1为 。
(2)生产过程中多次进行过滤,实验室进行过滤操作中需用到玻璃棒,下列实验操作中哪些操作中玻璃棒的作用完全相同的是 (填选项字母)。
①配制0.1mol/L的H2SO4溶液
②测定Na2CO3溶液的pH
③用KI淀粉试纸检验溶液中的氧化性离子
④加热食盐溶液制备NaCl晶体
⑤配制20%的KNO3溶液
A.①⑤ B.②③ C.④⑤ D.①④
(3)加入H2O2发生的主要反应的离子方程式为 ;加入Na2CO3溶液调pH至4.0~4.5,其目的为 ; 加入NH4F后除掉的杂质是 。
加入NH4F后除掉的杂质是 。
(4)草酸镍(NiC2O4·2H2O)在热空气中干燥脱水后在高温下煅烧三小时,制得Ni2O3,同时获得混合气体。草酸镍受热分解的化学方程式为 。
(5)工业上还可用电解法制取Ni2O3。用NaOH溶液调节NiCl2溶液的pH至7.5,加入适量Na2SO4后采用惰性电极电解。电解过程中产生的Cl2有80%在弱碱性条件下生成ClO-,再把二价镍氧化为三价镍。ClO-氧化Ni(OH)2生成Ni2O3的离子方程式为 。amol二价镍全部转化为三价镍时,外电路中通过电子的物质的量为 。
(6)电解法制取Ni2O3的实际过程中,有时获得一种结晶水合物,已知含1molNi的该物质中含有0.5mol结晶水。取该化合物20.2g进行充分加热,获得Ni2O3固体和0.2mol水,则该结晶水合物的化学式为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
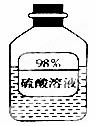
(1)如图信息,瓶中溶液长期放置后溶质质量分数变小,是因为该物质具有 性。(1分)
(2)某探究小组的同学对某工业废水(含有H2SO4、HNO3)中H2SO4的含量进行测定.取50g废水于烧杯中,加入足量BaCl2溶液、过滤、 洗涤、干燥,得BaSO4固体11.65g.请解答下列问题:
洗涤、干燥,得BaSO4固体11.65g.请解答下列问题:
①计算50g废水中H2SO4的溶质质量分数。(3分,要求写出计算过程)
②若改用KOH溶液(利用消耗的KOH的质量)测定50g废水中H2SO4的含量,结果可能会 ______(选填“偏低”、“偏高”或“不变”),原因是____________________。(每空
查看答案和解析>>
科目:高中化学 来源: 题型:
相同温度下,根据三种酸的电离常数,下列判断正确的是( )
| 酸 | HX | HY | HZ |
| 电离常数K | 9×10-7 | 9×10-6 | 10-2 |
A.三种酸的强弱关系:HX>HY>HZ
B.反应HZ+Y-====HY+Z-能够发生
C.相同温度下,0.1 mol·L-1的NaX、NaY、NaZ溶液,NaZ溶液pH最大
D.相同温度下,1 mol·L-1HX溶液的电离常数大于0.1 mol·L-1HX
查看答案和解析>>
科目:高中化学 来源: 题型:
下列叙述正确的是( )
A.由同种元素组成的物质肯定属于纯净物
B.一种元素可形成多种离子,但只能是带同种电荷的离子
C.含金属元素的离子不一定都是阳离子
D.具有相同质子数的粒子都属于同种元素
查看答案和解析>>
科目:高中化学 来源: 题型:
今有A、B两种元素的原子,已知A原子M层有x个电子,N层有y个电子,B原子的M层有(x+5)个电子,N层有(y+5)个电子,则A、B分别是 (填写元素符号)_____________,其电子排布式分别为_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
室温下,已知某溶液中由水电离生成的H+和OH-的物质的量浓度乘积为1×10-24,则在该溶液中,一定不能大量存在的离子是( )
A.S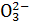 B.N
B.N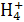 C.N
C.N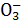 D.HC
D.HC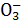
查看答案和解析>>
科目:高中化学 来源: 题型:
(CH3)3NH+和AlCl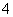 可形成离子液体。离子液体由阴、阳离子组成,熔点低于100℃,其挥发性一般比有机溶剂________(填“大”或“小”),可用作____________(填代号)。
可形成离子液体。离子液体由阴、阳离子组成,熔点低于100℃,其挥发性一般比有机溶剂________(填“大”或“小”),可用作____________(填代号)。
a.助燃剂 b.“绿色”溶剂
c.复合材料 d.绝热材料
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com