
下列陈述Ⅰ、Ⅱ正确并且有因果关系的是
选项 | 陈述Ⅰ | 陈述Ⅱ |
A | SO3溶于水后能导电 | SO3为电解质 |
B | 铁比铜活泼 | 铜板上的铁钉在潮湿空气中容易生锈 |
C | 浓H2SO4有强氧化性 | 浓H2SO4常温下能与Cu发生反应 |
D | 小苏打可做焙制糕点的膨松剂 | NaHCO3能与碱反应 |
 学习实践园地系列答案
学习实践园地系列答案科目:高中化学 来源:2014-2015云南省高一3月月考化学试卷(解析版) 题型:填空题
(6分)现有0.1 mol·L-1的Na2SO4和0.1 mol·L-1的H2SO4混合溶液100mL,向其中逐滴加入0.2 mol·L-1的 Ba(OH)2溶液,并不断搅拌,使反应充分进行。(忽略混合过程中的体积变化)
(1)当加入50 mLBa(OH)2溶液时,所得溶液中的溶质是 ,其物质的量浓度为 mol·L-1。
(2)当溶液中沉淀量达到最大时,所加Ba(OH)2溶液的体积为 mL,所得溶液中溶质为 ,则该溶质物质的量浓度为 mol·L-1
查看答案和解析>>
科目:高中化学 来源:2014-2015陕西省宝鸡市高一4月月考化学试卷(解析版) 题型:选择题
根据原子结构及元素周期律的知识,下列推断正确的是
A.同主族元素含氧酸的酸性随核电荷数的增加而减弱
B.核外电子排布相同的微粒化学性质也相同
C.Cl-、S2-、Ca2+、K+半径逐渐减小
D.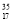 Cl与
Cl与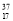 Cl得电子能力相同
Cl得电子能力相同
查看答案和解析>>
科目:高中化学 来源:2014-2015学年北京市海淀区高三一模理综化学试卷(解析版) 题型:选择题
下列解释事实的方程式正确的是
A.在空气中切开金属钠,光亮表面变暗:2Na+O2===Na2O2
B.向氯化铝溶液中加入过量氨水,产生白色沉淀:Al3+ + 3OH-===Al(OH)3↓
C.将铁粉与水蒸气共热,产生气体:2Fe+3H2O(g)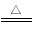 Fe2O3+3H2
Fe2O3+3H2
D.电解饱和氯化钠溶液,产生气体:2NaCl+2H2O  2NaOH+H2↑+Cl2↑
2NaOH+H2↑+Cl2↑
查看答案和解析>>
科目:高中化学 来源:2014-2015学年广东湛江高三第二次模拟考试理综化学试卷(解析版) 题型:填空题
(16分)乙酰水杨酸是一种使用广泛的解热镇痛剂。合成原理是:
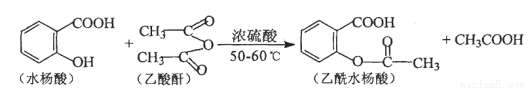
(1)乙酰水杨酸的分子式为 ,1 mol乙酰水杨酸最多能与 mol H2 反应。
(2)上面反应的反应类型是 。
(3)有关水杨酸的说法,不正确的是 。
A.能与溴水发生取代反应和加成反应
B.可发生酯化反应和水解反应
C.1 mol水杨酸最多能与2 mol NaOH反应
D.遇FeCl3溶液显紫色
(4)乙酰水杨酸与足量KOH溶液反应的化学方程式为 。
(5)乙酰氯(CH3COCl )也可以与水杨酸反应生成乙酰水杨酸,请写出化学反应方程式(不写条件) 。
(6)写出一种符合下列条件的乙酰水杨酸的同分异构体的结构简式: 。
Ⅰ.能遇FeCl3溶液显色
Ⅱ.苯环上只有2种一溴取代物
Ⅲ.1 mol该化合物能分别与含4 mol Br2的溴水或4 mol H2 反应
查看答案和解析>>
科目:高中化学 来源:2014-2015学年甘肃省天水市高三下学期二模考试理综化学试卷(解析版) 题型:填空题
〔化学—选修3:物质结构与性质〕(15分)已知A、B、C、D、E五种元素的原子序数依次递增,A、B、C、D位于短周期。A位于周期表的s区,其原子中电子层数和未成对电子数相同;B的基态原子中电子占据三种能量不同的原子轨道,且每种轨道中的电子总数相同;D原子最外层电子数是次外层电子数的3倍。E有“生物金属”之称,E4+和氩原子的核外电子排布相同。
请回答下列问题:
(1)B、C、D三种元素的电负性由小到大的顺序为 ,E的基态原子的电子排布式为 。
(2)由B、D形成的BD32 -离子中,其VSEPR模型名称是 ,离子的中心原子采用 杂化。
(3)已知由A、C、D三种元素按照4:2:3的原子个数比可形成某离子化合物,常温下测得该离子化合物的水溶液pH=5,则该溶液中水电离出的氢离子浓度为 。
(4)D、E和钡三种元素构成的某化合物的晶胞结构如图所示,该化合物的化学式为 。

纳米级的EO2是一种广泛使用的催化剂,实验室往往通过ECl4在大量水中加热水解制得EO2·xH2O,该反应的化学方程式为 。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年甘肃省天水市高三下学期二模考试理综化学试卷(解析版) 题型:选择题
卤素互化物与卤素单质性质相似。已知CH2=CH—CH=CH2(1,3—丁二烯)与氯气发生加成产物有三种:
①CH2Cl—CHCl—CH=CH2 (1,2—加成)
②CH2Cl—CH=CH—CH2Cl (1,4—加成)
③CH2Cl—CHCl—CHCl—CH2Cl(完全加成)
据此推测CH2=C(CH3)—CH=CH2(异戊二烯)与卤素互化物BrCl的加成产物有几种(不考虑顺反异构和镜像异构
A.6种 B.10种 C.12种 D.14种
查看答案和解析>>
科目:高中化学 来源:2014-2015学年北京市海淀区高三第二学期期末练习理综化学试卷(解析版) 题型:简答题
(14分)某种锂离子电池的正极材料是将含有钴酸锂(LiCoO2)的正极粉均匀涂覆在铝箔上制成的,可以再生利用。某校研究小组尝试回收废旧正极材料中的钴。
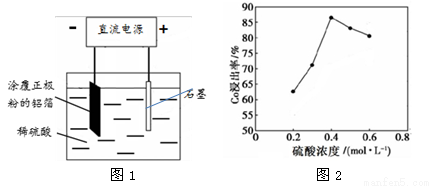
(1)25℃时,用图1所示装置进行电解,有一定量的钴以Co2+的形式从正极粉中浸出,且两极均有气泡产生,一段时间后正极粉与铝箔剥离。
①阴极的电极反应式为:LiCoO2 + 4H+ + e- === Li+ + Co2+ + 2H2O 、 。
阳极的电极反应式为 。
②该研究小组发现硫酸浓度对钴的浸出率有较大影响,一定条件下,测得其变化曲线如图2所示。当c(H2SO4) > 0.4 mol·L-1时,钴的浸出率下降,其原因可能为 。
(2)电解完成后得到含Co2+的浸出液,且有少量正极粉沉积在电解槽底部。用以下步骤继续回收钴。
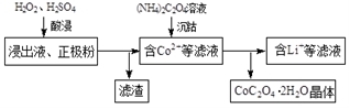
①写出“酸浸”过程中正极粉发生反应的化学方程式 。该步骤一般在80℃以下进行,温度不能太高的原因是 。
②已知(NH4)2C2O4溶液呈弱酸性,下列关系中正确的是 (填字母序号)。
a.c (NH4+)> c(C2O42-)>c (H+)>c (OH-)
b.c (H+) +c (NH4+) =c (OH-) + c(HC2O4-)+c(C2O42-)
c.c (NH4+)+ c (NH3H2O ) = 2[c(C2O42-) + c(HC2O4-) + c(H2C2O4)]
(3)已知所用锂离子电池的正极材料为x g,其中LiCoO2(M = 98 g·mol-1)的质量分数为a%,则回收后得到CoC2O42H2O (M = 183 g·mol-1)的质量不高于 g。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年上海市五校高三第二学期联考化学试卷(解析版) 题型:选择题
常温下,向20 mL 0.2 mol/L H2A溶液中滴加0.2 mol/L NaOH溶液。有关微粒的物质的量变化如图所示(其中Ⅰ代表H2A,Ⅱ代表HA-,Ⅲ代表A2-),根据图示判断,下列说法正确的是

A.当V[NaOH(aq)]=20 mL时,溶液中离子浓度大小关系:
c(Na+)>c(HA-)>c(H+)>c(A2-)>c(OH-)
B.等体积等浓度的NaOH溶液与H2A溶液混合后,其溶液中水的电离程度比纯水大
C.H2A第一步电离的方程式为H2A→HA- +H+
D.向NaHA溶液加入水稀释的过程中,pH可能增大也可能减少
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com