
(18分)研究SO2、NOx、CO等气体的性质对工业生产和环境保护具有重要意义。
(1)相同物质的量的SO2与NH3溶于水发生反应的离子方程式为________________,所得溶液中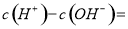 _________ (填字母编号)。
_________ (填字母编号)。

(2)通过NOx传感器可监测大气中NOx的含量,其工作原理如图所示,甲、乙两电极均Pt电极,电解质为熔融氧化物。

①乙电极上发生的是_________反应(填“氧化”或“还原”);
②甲电极上的电极反应式为___________________。
(3)将不同物质的量的H2O(g)和 CO分别通入体积为2L的恒容密闭容器中,发生反应:H2O(g)+CO(g) CO2(g)+H2(g) △H,得到如下数据:
CO2(g)+H2(g) △H,得到如下数据:

①由表中数据可知该反应的△H________ 0(填“>”或“<”)。
②650℃时,若在此容器中开始充入2mol H2O(g)、lmol CO、1 mol CO2和2 molH2,则反应在开始时_________进行(填“正向”或“逆向”)。
③实验III中a=______,达平衡时实验II和实验III中H2O(g)的转化率的大小关系为: (填“>”、“<”或“=”)。
(填“>”、“<”或“=”)。
(18分)
(1)SO2+NH3+H2O===NH4++HSO3-(3分) BD(3分)
(2)①还原(2分)
②NO-2e-+O2-===NO2(2分)
(3)①< (2分) ②正向(2分)
③ 0.6 (2分) >(2分)
【解析】
试题分析:(1)相同物质的量的SO2与NH3溶于水生成NH4HSO3,所以离子方程式为:SO2+NH3+H2O===NH4++HSO3-;根据电荷守恒可得:c(H+)+c(NH4+)=c(OH)+c(HSO3)+2c(SO32),所以c(H+)—c(OH)= +c(HSO3)+2c(SO32)—c(NH4+),根据物料守恒可得:c(NH4+)+c(NH3H2O)=c(HSO3)+c(H2SO3)+c(SO32),与电荷守恒式相减可得:c(H+)—c(OH)=c(SO32)+c(NH3H2O)—c(H2SO3),故答案为BD。
(2)①根据O22移动方向可知乙为原电池的正极,发生还原反应。
②根据示意图可知NO在甲电极上与O2反应生成NO2,电极方程式为:NO-2e-+O2-===NO2。
(3)①对比实验I与实验II数据可知,温度升高,CO的转化率减小,所以正反应为放热反应,故H < 0。
②根据表中650℃时数据可知:H2O(g)+CO(g) CO2(g)+H2(g)
CO2(g)+H2(g)
初始浓度(molL1) 1 2 0 0
转化浓度(molL1) 0.8 0.8 0.8 0.8
平衡浓度(molL1) 0.2 1.2 0.8 0.8
则650℃时平衡常数K=0.8×0.8/(0.2×1.2)=2.67,充入2mol H2O(g)、lmol CO、1 mol CO2和2 molH2,浓度商Q==0.5×1/(1×0.5)=1 < K,所以开始时反应向正反应方向进行。
③根据表中反应II的数据,CO、H2O的转化量为0.4mol,则反应III的转化量也是0.4mol,所以平衡时a=1mol—0.4mol=0.6mol;实验II中H2O的初始量为1mol、CO的初始量为2mol,实验III中H2O的初始量为2mol、CO的初始量为1mol,所以实验IIH2O的转化率大于实验III。
考点:本题考查离子浓度比较、原电池原理、化学平衡常数、化学平衡。
考点分析: 考点1:电化学基础 考点2:化学平衡状态及移动 考点3:盐类水解 试题属性

科目:高中化学 来源:2014-2015山东省枣庄市高一上学期期末化学试卷(解析版) 题型:填空题
(7分)某棕黄色气体A由两种前18号常见元素组成,测得同温同压下该气体对空气的相对 密度为3.0,A溶于水只生成一种产物B,B的溶液在放置过程中其酸性会增强并放出一种单质气体C。A可用另一种单质气体D与潮湿的Na2CO3反应制得,同时生成两种钠盐;单质气体D也可和HgO反应制得A。请回答下列问题:
(1)气体A的化学式为____ ______。
(2)用化学方程式表示B溶液酸性增强的原因____ ______。
(3)气体单质D与潮湿的Na2CO3 反应制得制取A的化学方程式为____ ______。
(4)气体单质D与HgO反应制得A的化学方程式为____ ______。
查看答案和解析>>
科目:高中化学 来源:2014-2015江西省新余市高一上学期期末考试化学试卷(解析版) 题型:选择题
下列有关金属及其化合物的知识说法正确的是
A.观察焰色反应实验为黄色火焰,则可证明该溶液中含有Na+
B.金属单质导电与电解质溶液导电原因是一样的
C.常温下浓硫酸与铁不反应,故常温下可用铁制容器贮藏贮运浓硫酸
D.可用Na与MgCl2溶液反应制Mg
查看答案和解析>>
科目:高中化学 来源:2014-2015学年四川省遂宁市高三第二次诊断考试化学试卷(解析版) 题型:推断题
(15分)某种降血压药物H(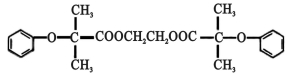 )可由下列路线合成:
)可由下列路线合成:
已知:

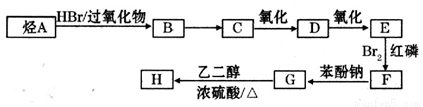
回答下列问题:
(1)A的名称为 。
(2)B→C的反应条件为 ,F→G的反应类型为 。
(3)D的结构简式为 。
(4)符合下列条件G的同分异构体有 种,其中核磁共振氢谱为5组峰的为 (写结构简式)。
①能使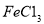 溶液显紫色;②苯环上只有2个取代基;
溶液显紫色;②苯环上只有2个取代基;
③1mol该物质最多可消耗3molNaOH。
(5)G→H的化学方程式为 。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年四川省遂宁市高三第二次诊断考试化学试卷(解析版) 题型:选择题
下列离子方程式的书写及评价均合理的是
选项 | 离子方程式 | 评价 |
A | 将2 mol Cl2通入到含1 mol FeI2的溶液中: 2Fe2++2I-+2Cl2===2Fe3++4Cl-+I2 | 正确; Cl2过量,Fe2+、I-均被氧化 |
B | 用Cu电极电解NaCl溶液,阳极的电极反应式: 2Cl--2e-===Cl2↑ | 正确; Cl-优先于OH-放电 |
C | 过量SO2通入到NaClO溶液中: SO2+H2O+ClO-===HClO+HSO3- | 正确; H2SO3的酸性强于HClO |
D | Mg(HCO3)2溶液与足量的NaOH溶液反应: Mg2++2HCO3-+4OH-=== Mg(OH)2 ↓ + 2 CO32-+2 H2O | 正确; Mg(OH)2比MgCO3更难溶 |
查看答案和解析>>
科目:高中化学 来源:2014-2015学年山东省日照市高三3月模拟考试理综化学试卷(解析版) 题型:选择题
镁铝合金5.4g溶于过量的热浓硝酸中,反应产生11.2 LNO2(标准状况),若在反应后溶液中加入过量的氢氧化钠溶液,则生成沉淀质量为
A.4.5g B.6 g C.8.7g D.13.9g
查看答案和解析>>
科目:高中化学 来源:2014-2015学年湖南省怀化市高三第一次模拟考试理综化学试卷(解析版) 题型:填空题
(14分)CO和H2的混合气体俗称合成气,是一种重要的工业原料气,工业上利用天
然气(主要成分为CH4)与水进行高温重整制备合成气。
(1)已知:CH4、H2和CO的燃烧热(△H)分别为-890.3kJ/mol、-285.8kJ/mol和-283.0kJ/mol,且1mol液态水汽化时的能量变化为44.0kJ。用1 m3(标准状况)的甲烷与水蒸气在高温下反应制取合成气所需的热量为 (保留整数)。
(2)在一定温度下,向体积为2L的密闭容器中充入0.40mol CH4和0.60mol H2O(g),测得CH4(g)和H2(g)的物质的量浓度随时间变化如下表所示:

①计算该反应第一次达平衡时的平衡常数K 。
②3min时改变的反应条件是 (只填一种条件的改变即可)。
(3)已知温度、压强、投料比X[n(CH4)/n(H2O)]对该反应的影响如图所示。
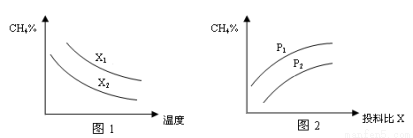
①图1中的两条曲线所示投料比的关系X1 X2(填“=”、“>”或“<”下同)。
②图2中两条曲线所示的压强比的关系:P1 P2。
(4)以天然气(设杂质不参与反应)、KOH溶液为原料可设计成燃料电池:
①放电时,负极的电极反应式为 。
②设装置中盛有100.0mL 3.0mol/L KOH溶液,放电时参与反应的氧气在标准状况下的体积为8.96L,放电过程中没有气体逸出,则放电完毕后,所得溶液中各离子浓度由大到小的关系为 。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年福建省泉州五校高三上学期摸底联考化学试卷(解析版) 题型:选择题
下列陈述I、II正确并且有因果关系的是
选项 | 陈述I | 陈述II |
A | SO2和氯水有漂白性 | 两者都能使溴水褪色 |
B | 用淀粉-KI鉴别FeCl2 | Fe2+有氧化性 |
C | 盐酸和氨水能溶解Al(OH)3 | Al(OH)3是两性氢氧化物 |
D | CuSO4可以用作消毒剂 | 铜盐能使蛋白质变性 |
查看答案和解析>>
科目:高中化学 来源:2014-2015学年北京市石景山区高三上学期期末考试化学试卷(解析版) 题型:填空题
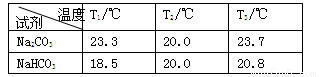
(10分)某小组探究Na2CO3和NaHCO3的性质,实验步骤及记录如下:
Ⅰ.分别向盛有0.5 g Na2CO3固体、0.5 gNaHCO3固体的烧杯中加入10 mL水(20℃),搅拌,测量温度为T1;
Ⅱ.静置恒温后测量温度为T2 ;
Ⅲ.分别加入10 mL 密度约为1.1 g/mL 20%的盐酸(20℃),搅拌,测量温度T3。
得到下表的数据:
回答下列问题:
(1)Na2CO3溶于水显碱性,其原因是 (用离子方程式表示)。
(2)根据试题后的附表判断:步骤Ⅰ中Na2CO3、NaHCO3固体分别是全部溶解还是部分溶解_________。
(3)分析表1的数据得出:Na2CO3固体溶于水______,NaHCO3固体溶于水______(填“放热”或“吸热”)。
(4)甲同学分析上述数据得出:Na2CO3和NaHCO3与盐酸反应都是放热反应。
乙同学认为应该增加一个实验,并补做如下实验:向 盛 有10 mL水(20℃)的烧杯中加入10 mL_____,搅拌,测量温度为22.2℃。
(5)结合上述探究,下列说法正确的是__________。
A.NaHCO3与盐酸的反应是吸热反应
B.不能用稀盐酸鉴别Na2CO3和NaHCO3固体
C.Na2CO3、NaHCO3固体与稀盐酸反应的能量变化还与物质的溶解等因素有关
(6)丙同学为测定一份NaHCO3和Na2CO3混合固体中NaHCO3的纯度,称取m1 g混合物,加热至质量不变时,称其质量为m2 g,则原混合物中NaHCO3的质量分数为_____(用代数式表示)。
附表:溶解度表

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com