
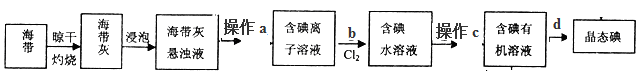
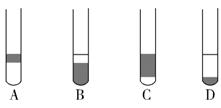


科目:高中化学 来源:不详 题型:单选题
| 物质 | 分子式 | 熔点℃ | 沸点℃ | 密度g?cm-3 | 水溶性 |
| A | C3H6O2 | -98 | 57,5 | 0,93 | 可溶 |
| B | C4H8O2 | -84 | 77 | 0,90 | 可溶 |
| A.萃取 | B.升华 | C.分馏 | D.分液 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题

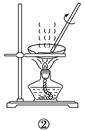
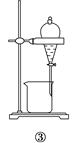

| A.分离Na2CO3溶液和CH3COOC2H5,选④ |
| B.用CCl4提取碘水中的碘,选③ |
| C.用FeCl2溶液吸收Cl2,选⑤ |
| D.粗盐提纯,选①和② |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.用氢气除去乙烷中混有的少量乙烯 |
| B.用金属钠除去乙醇中混有的少量水 |
| C.用酸性高锰酸钾溶液除去甲烷中混有的少量乙烯 |
| D.用饱和碳酸氢钠溶液除去二氧化碳中混有的少量氯化氢 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| 选项 | 混合物 | 试剂 | 分离方法 |
| A. | 溴乙烷(乙醇) | 生石灰 | 蒸馏 |
| B. | 甲烷(乙烯) | 酸性高锰酸钾溶液 | 洗气 |
| C. | 苯(硝基苯) | 蒸馏水 | 分液 |
| D. | 苯甲酸(NaCl) | 蒸馏水 | 重结晶 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
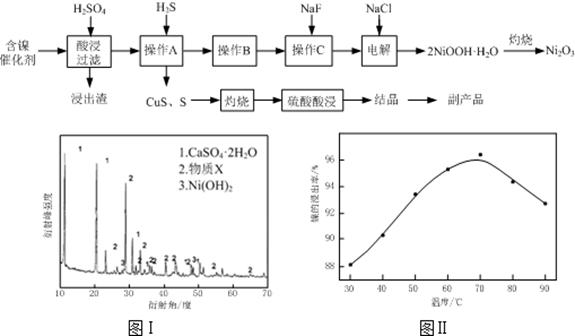
| 氢氧化物 | Fe(OH)3 | Fe(OH)2 | Ni(OH)2 |
| 开始沉淀的pH | 1.5 | 6.5 | 7.7 |
| 沉淀完全的pH | 3.7 | 9.7 | 9.2 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
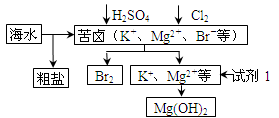
| A.试剂1可以选用石灰乳 |
| B.从苦卤中提取Br2的反应的离子方程式为:2Br - + Cl2=2Cl- + Br2 |
| C.工业上,电解熔融MgO冶炼金属镁可减小能耗 |
| D.可用BaCl2溶液除去粗盐中的SO42- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com