
 是地球上最常见的物质之一,是所有生命体生存的重要资源,约占人体体重的三分之二.
是地球上最常见的物质之一,是所有生命体生存的重要资源,约占人体体重的三分之二. 无色,无气味并且易燃.是常见的一种基础能源.
无色,无气味并且易燃.是常见的一种基础能源.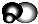 有强氧化性的弱酸,可以用于消毒杀菌.
有强氧化性的弱酸,可以用于消毒杀菌.分析 四种短周期元素A、B、C、D,四种元素之间形成的某三种分子的比例模型及部分性质如下:
甲: 是地球上最常见的物质之一,是所有生命体生存的重要资源,约占人体体重的三分之二,则甲是H2O;
是地球上最常见的物质之一,是所有生命体生存的重要资源,约占人体体重的三分之二,则甲是H2O;
乙: 无色,无气味并且易燃,是常见的一种基础能源,则乙是CH4;
无色,无气味并且易燃,是常见的一种基础能源,则乙是CH4;
丙: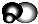 有强氧化性的弱酸,可以用于消毒杀菌,则丙是HClO,
有强氧化性的弱酸,可以用于消毒杀菌,则丙是HClO,
因为原子半径A>B>C>D,所以A、B、C、D分别是Cl>C>O>H,
(1)主族元素原子核外电子层数等于其周期数,最外层电子数等于其族序数,据此判断B元素在周期表中的位置;CO2分子是直线形结构,C原子和每个O原子形成两个共用电子对;
(2)A所在周期中,E元素的单质还原性最强,则E是Na元素;F元素的某些盐类常用作净水剂,则F是Al元素;E单质与甲反应有化合物X,X为NaOH,
①氯气和水反应生成HCl和HClO;
②Al、O两种元素组成的化合物Y为Al2O3,氧化铝和NaOH反应生成偏铝酸钠和水.
解答 解:四种短周期元素A、B、C、D,四种元素之间形成的某三种分子的比例模型及部分性质如下:
甲: 是地球上最常见的物质之一,是所有生命体生存的重要资源,约占人体体重的三分之二,则甲是H2O;
是地球上最常见的物质之一,是所有生命体生存的重要资源,约占人体体重的三分之二,则甲是H2O;
乙: 无色,无气味并且易燃,是常见的一种基础能源,则乙是CH4;
无色,无气味并且易燃,是常见的一种基础能源,则乙是CH4;
丙: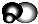 有强氧化性的弱酸,可以用于消毒杀菌,则丙是HClO,
有强氧化性的弱酸,可以用于消毒杀菌,则丙是HClO,
因为原子半径A>B>C>D,所以A、B、C、D分别是Cl>C>O>H,
(1)主族元素原子核外电子层数等于其周期数,最外层电子数等于其族序数,B是C元素,其原子核外有2个电子层、最外层电子数是4,所以位于第二周期第IVA族;CO2分子是直线形结构,C原子和每个O原子形成两个共用电子对,结构式为O=C=O,
故答案为:第二周期第IVA族;O=C=O;
(2)A所在周期中,E元素的单质还原性最强,则E是Na元素;F元素的某些盐类常用作净水剂,则F是Al元素;E单质与甲反应有化合物X,X为NaOH,
①氯气和水反应生成HCl和HClO,离子反应方程式为Cl2+H2O=H++Cl-+HClO,故答案为:Cl2+H2O=H++Cl-+HClO;
②Al、O两种元素组成的化合物Y为Al2O3,氧化铝和NaOH反应生成偏铝酸钠和水,离子反应方程式为 Al2O3+2OH-=2AlO2-+H2O,
故答案为:Al2O3+2OH-=2AlO2-+H2O.
点评 本题考查位置结构性质相互关系及应用,侧重考查元素推断、离子方程式的书写、物质结构等知识点,知道离子方程式的书写规则及物质性质即可解答,题目难度不大.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:解答题


查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na2CO3 是碱 | B. | Na2C03 是盐 | C. | Na2C03是钠盐 | D. | Na2CO3是碳酸盐 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | pH=a的H2S溶液中,c(H+)=c(HS-)=1×10-amol.L-1 | |
| B. | 等物质的量的Na2CO3和NaHCO3混合液:c(HCO3)>c(CO32-) | |
| C. | H2C204 与 NaOH 溶液任意比例混合:c(Na+)+c(H+)=c(OH-)+c( HC204-) | |
| D. | (NH4)2SO4 溶液中:c(SO42-)=2c(NH4+)+2c(NH3•H20) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | A、C两种元素可组成化学式为C2A4的化合物 | |
| B. | E氧化物的水化物有两性 | |
| C. | F与D形成的化合物性质很不活泼,不与任何酸反应 | |
| D. | 元素的非金属性由强到弱的顺序是D>C>F>B |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na2CO3溶液加水稀释后,恢复至原温度,pH和Kw均减小 | |
| B. | NH4Cl、CH3COONa、NaHCO3、NaHSO3溶于水,对水的电离都有促进作用 | |
| C. | 浓度均为0.10mol•L-1 NH4Cl和NH4HSO4溶液,c(NH4+)前者大于后者 | |
| D. | 可用Na2CO3溶液处理水垢中的CaSO4,转化为易于除去的CaCO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
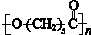 .其合成路线如下.
.其合成路线如下.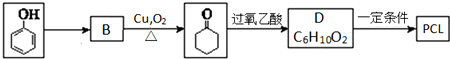

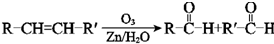
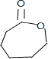 .上述生成D的反应类型是氧化反应.
.上述生成D的反应类型是氧化反应.
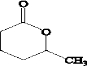 .
.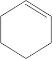 、XOHCCH2CH2CH2CH2CHO.
、XOHCCH2CH2CH2CH2CHO.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com