
【题目】铅蓄电池的工作原理为:Pb+PbO2+2H2SO4=2PbSO4+2H2O,研读如图,下列判断错误的是
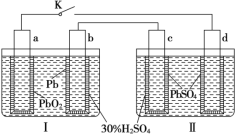
A.K闭合时,d电极反应式:PbSO4+2H2O-2e-=PbO2+4H++SO42-
B.当电路中转移0.2mol电子时,Ⅰ中消耗的H2SO4为0.2mol
C.K闭合时,Ⅱ中SO42-向c电极迁移
D.K闭合一段时间后,Ⅱ可单独作为原电池,c电极为负极
【答案】C
【解析】
根据铅蓄电池的工作原理,Ⅰ池中,a电极为正极,b电极为负极,K闭合后,Ⅱ池中,c电极为阴极,d电极为阳极。
A.K闭合时,d电极为阳极,PbSO4失电子生成PbO2等,电极反应式为:PbSO4+2H2O-2e-=PbO2+4H++SO42-,A正确;
B.Ⅰ中电池反应为Pb+PbO2+2H2SO4=2PbSO4+2H2O,2H2SO4~2e-,所以当电路中转移0.2mol电子时,消耗的H2SO4为0.2mol,B正确;
C.K闭合时,Ⅱ中SO42-向阳极移动,即向d电极迁移,C错误;
D.K闭合一段时间后,Ⅱ的电极材料分别为Pb(c电极)、PbO2(d电极),电解质为H2SO4,所以可单独作为原电池,且c电极为负极,D正确;
故选C。


 尖子生新课堂课时作业系列答案
尖子生新课堂课时作业系列答案科目:高中化学 来源: 题型:
【题目】如图为Zn-聚苯胺二次电池的示意图,下列说法正确的是( )
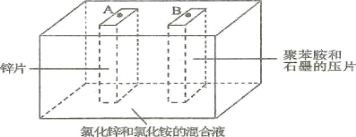
A.放电时,Zn片做负极,发生的电极方程式为Zn + 2e-=Zn2+
B.放电时,混合液中的Cl-向B移动
C.充电时,聚苯胺被氧化
D.充电时,A端接电源的正极
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硼是新型无机材料中的明星元素。

(1)磷化硼是一种耐磨涂料,可由三溴化硼和三溴化磷高温下在氢气中反应合成,其化学方程式为 ______,图为磷化硼晶体结构中最小的重复单元,磷化硼的晶体类型是 ______,一个晶胞中含 ______个P原子,每个B或P均形成4个共价键,其中有一个配位键,提供空轨道的是 ______原子。
(2)氮化硼是一种重要的功能陶瓷材料,其结构与磷化硼相似,B和N相比,电负性较大的是 ______(填元素符号),其基态原子的电子排布式为 ______,氮化硼中B元素的化合价为 ______。
(3)环硼氮烷与苯是等电子体,其一氯代物有两种结构、二氯代物有四种结构,写出环硼氮烷分子结构式 ______。
(4)BF3用作有机合成中的催化剂,也用于制造火箭的高能燃料。在BF3分子中,F-B-F的键角是 ______ 度,B原子采用 ______ 杂化;BF3和过量NaF作用可生成NaBF4,BF4-的立体构型为 ______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求回答下列问题:
(1)3—甲基—1一丁炔的结构简式为_____________
(2)![]() 的分子式为_____________
的分子式为_____________
(3)烃A在同温、同压下蒸气的密度是H2的35倍,其分子式为_____________。
(4)分子式为C8H10属于芳香烃的同分异构体共有_____________种,其中____________(填结构简式)在苯环上的一氯取代产物有两种。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】KClO3和浓盐酸在一定温度下反应,还原产物为黄绿色的易爆物二氧化氯。其变化可以表示为:_____KClO3+________HCl(浓)→_________KCl+_______ClO2↑+______Cl2↑+__________H2O
(1)请配平该化学方程式(未知系数填入横线内)。
(2)浓盐酸在反应中显示出来的性质是________(填编号)。
①只有还原性 ②还原性和酸性 ③只有氧化性 ④氧化性和酸性
(3)5 ℃ 下将产物氯气0.1 mol溶于水配成1 L溶液,请写出氯气溶于水的化学反应方程式____________________。
(4)若改变温度至70 ℃,发现KClO3和浓盐酸反应的氧化产物和还原产物均为二氧化氯气体,试写出反应的化学方程式:______________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用。
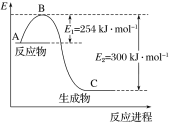
(1)上图是N2(g)和H2(g)反应生成1 mol NH3(g)过程中能量的变化示意图,请写出N2和H2反应的热化学方程式:______________。
(2)若已知下列数据:
化学键 | H—H | N≡N |
键能/kJ·mol-1 | 435 | 943 |
试根据表中及图中数据计算N—H的键能:________ kJ·mol-1。
(3)用NH3催化还原NOx还可以消除氮氧化物的污染。已知:
4NH3(g)+3O2(g)=2N2(g)+6H2O(g) ΔH1=-a kJ·mol-1①
N2(g)+O2(g)===2NO(g) ΔH2=-b kJ·mol-1②
若1 mol NH3还原NO至N2,则该反应过程中的反应热ΔH3=________ kJ·mol-1(用含a、b的式子表示)。
(4)捕碳技术(主要指捕获CO2)在降低温室气体排放中具有重要的作用。目前NH3和(NH4)2CO3已经被用作工业捕碳剂,它们与CO2可发生如下可逆反应:
反应Ⅰ:2NH3(l)+H2O(l)+CO2(g) ![]() (NH4)2CO3(aq) ΔH1
(NH4)2CO3(aq) ΔH1
反应Ⅱ:NH3(l)+H2O(l)+CO2(g) ![]() NH4HCO3(aq) ΔH2
NH4HCO3(aq) ΔH2
反应Ⅲ:(NH4)2CO3(aq)+H2O(l)+CO2(g) ![]() 2NH4HCO3(aq) ΔH3
2NH4HCO3(aq) ΔH3
则ΔH3与ΔH1、ΔH2之间的关系是ΔH3=________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是进行气体性质实验的常用装置,液体一定不能充满试管的是

A.若a为水,b是HClB.若a为水,b是NO2
C.若a为水(滴有酚酞),b是NH3D.若a为NaOH溶液,b是Cl2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关离子方程式正确的是( )
A.将氟气通入水中: ![]() =
=![]()
B.硝酸银溶液中滴加过量氨水: ![]() =
=![]()
C.将磁性氧化铁溶于盐酸: ![]() =
=![]()
D.往![]() 溶液中滴入
溶液中滴入![]() 溶液至沉淀的物质的量最大
溶液至沉淀的物质的量最大![]() =
=![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】科学家发现对冶金硅进行电解精炼提纯可降低高纯硅制备成本。相关电解槽装置如图所示,用Cu-Si合金作硅源,在950℃利用三层液熔盐进行电解精炼,有关说法不正确的是( )
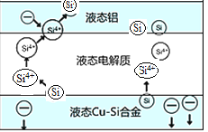
A.电子由液态Cu-Si合金流出,从液态铝电极流入
B.液态铝电极与负极相连,作为电解池的阴极
C.在该液相熔体中Cu优先于Si被氧化,Si4+优先于Cu2+被还原
D.三层液熔盐的作用是增大电解反应的面积,提高沉硅效率
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com