
【题目】下列物质:①固体烧碱 ②HCl气体 ③SO3 ④CCl4⑤石墨 ⑥浓硫酸 ⑦液态醋酸 ⑧碳酸钙 ⑨熔融KCl中,(填编号,下同)
属于强电解质的是____________________,属于非电解质的是__________________,能导电的是___________________________
 百年学典课时学练测系列答案
百年学典课时学练测系列答案 仁爱英语同步练习册系列答案
仁爱英语同步练习册系列答案 学习实践园地系列答案
学习实践园地系列答案科目:高中化学 来源: 题型:
【题目】已知淀粉酶的成分为蛋白质,可将淀粉分解为葡萄糖。分析表格,可推测( )
溶液 | 双缩脲试剂 | 碘液 | 斐林试剂 |
甲 | + | - | - |
乙 | - | ++ | - |
甲、乙混合 | + | + | + |
注:“+”显色,“++”显色更深;“-”不显色。
A. 甲溶液含有淀粉 B. 乙溶液含有还原性糖
C. 混合溶液不含淀粉 D. 混合溶液含有淀粉酶
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了探究不溶性盐X(仅含5种元素)的组成和性质,设计并完成如下实验(所加试剂均过量,气体体积均在标准状况下测定)。

请回答:
(1)X的组成元素为H、O和______(用元素符号表示),气体C的电子式为_______。
(2)写出反应①的离子方程式:______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究氮的氧化物具有重要意义。回答下列问题:
(1)2016年10月19日“天宫二号”与“神舟十一号”顺利实现太空交会对接。运载火箭用的是一种叫肼(N2H4)的燃料和氧化剂NO2,两者反应生成氮气和气态水。
已知: N2 (g) + 2O2 (g) = 2NO2 (g) △H = +67.7 kJ·mol-1
N2 H4 (g) +O2 (g) = N2 (g) +2H2 O (g) △H =-543 kJ·mol-1
①写出肼和NO2反应的热化学方程式__________________________________。
②若已知: 2H2(g)+O2(g)=2H2O(g) ΔH1=-Q1 kJ·mol-1;
2H2(g)+O2(g)=2H2O(l) ΔH2=-Q2 kJ·mol-1,
则 Q1_________Q2(填“>”“<”或“=”)。
(2)汽车尾气净化器中发生的反应为2NO(g)+2CO(g)![]() N2(g)+2CO2(g)。一定条件下,在三个体积均为1.0 L恒容密闭容器中发生上述反应,测得有关实验数据如下:
N2(g)+2CO2(g)。一定条件下,在三个体积均为1.0 L恒容密闭容器中发生上述反应,测得有关实验数据如下:
容器 | 温度/(℃) | 起始物质的量(mol) | 平衡物质的量(mol) | ||||
NO | CO | N2 | CO2 | N2 | CO2 | ||
I | 400 | 0.2 | 0.2 | 0 | 0 |
| 0.12 |
II | 400 | 0.4 | 0.4 | 0 | 0 |
| x |
III | 300 | 0 | 0 | 0.1 | 0.2 | 0.075 |
|
①容器I中达到平衡所需时间2 s,则v(N2)=_______;
②x_____0.24(填“>”、“=”、“<”);△H_____0 (填“>”、“=”、“<”);
③若起始时向I中充入NO、CO各0.1 mol,N2、CO2各0.0 5 mol,开始时v(正)
___ v(逆) (填“>”、“=”、“<”)。
(3)SCR和NSR技术可有效降低柴油发动机在空气过量条件下的NOx排放。
①SCR(选择性催化还原)工作原理:
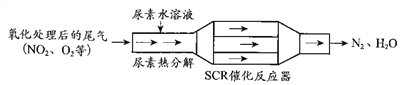
尿素溶液浓度影响NO2的转化,控制尿素的浓度非常关键。测定溶液中尿素(M=60 g·mol 1)含量的方法如下:取a g尿素溶液,将所含氮完全转化为NH3,所得NH3用过量的V1 mL c1 mol·L1 H2SO4溶液吸收完全,剩余H2SO4用V2 mL c2 mol·L1 NaOH溶液恰好中和,则尿素溶液中溶质的质量分数是________________________。
②NSR(NOx储存还原)工作原理:
NOx的储存和还原在不同时段交替进行,如图a所示。

通过BaO和Ba(NO3)2的相互转化实现NOx的储存和还原。储存NOx的物质是_______;
用H2模拟尾气中还原性气体研究了Ba(NO3)2的催化还原过程,该过程分两步进行,图b表示该过程相关物质浓度随时间的变化关系。第一步反应消耗的H2与Ba(NO3)2的物质的量之比是__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将4mol A气体和2molB气体置于2L密闭容器中,混合后发生如下反应:2A(g)+B(g)2C(g)+ D(s),若经2s后测得C的浓度为0.6molL-1,下列说法正确的是( )
A. 用物质A表示的反应速率为0.6mol(Ls)-1 B. 2s时物质B的含量为23.3%
C. 2s时物质A的转化率为30% D. 2s时物质B的浓度为0.3molL-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】1998年诺贝尔化学奖授予科恩和波普尔,以表彰他们在理论化学领域作出的重大贡献.他们的实验和理论能共同协力探讨分子体系的性质.下列说法正确的是
A.未来化学的研究方向是经验化B.化学不需要再做实验
C.化学不再是纯实验学科D.化学不做实验,就什么都不知道
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,向圆底烧瓶中加入1 molC2H5OH和含1molHBr的氢溴酸,溶液中发生反应;C2H5OH+HBr![]() C2H5Br+H2O,充分反应后达到平衡。已知常压下,C2H5Br和C2H5OH的沸点分别为38.4℃和78.5℃。下列有关叙述错误的是
C2H5Br+H2O,充分反应后达到平衡。已知常压下,C2H5Br和C2H5OH的沸点分别为38.4℃和78.5℃。下列有关叙述错误的是
A. 加入NaOH,可增大乙醇的物质的量
B. 增大HBr浓度,有利于生成C2H5Br
C. 若反应物增大至2 mol,则两种反应物平衡转化率之比不变
D. 若起始温度提高至60℃,可缩短反应达到平衡的时间
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图中反应①是制备SiH4的一种方法,其副产物MgCl2·6NH3是优质的镁资源。回答下列问题:
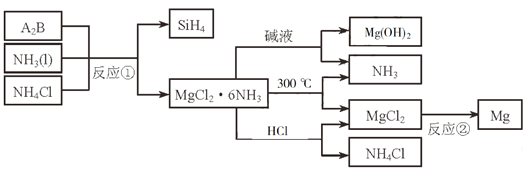
(1)MgCl2·6NH3所含元素的简单离子半径由小到大的顺序(H-除外):_________________________,Mg在元素周期表中的位置:_____________________,Mg(OH)2的电子式:____________________。
(2)A2B的化学式为_______________。反应②的必备条件是_______________。上图中可以循环使用的物质有_______________。
(3)在一定条件下,由SiH4和CH4反应生成H2和一种固体耐磨材料_______________(写化学式)。
(4)为实现燃煤脱硫,向煤中加入浆状Mg(OH)2,使燃烧产生的SO2转化为稳定的Mg化合物,写出该反应的化学方程式:_______________。
(5)用Mg制成的格氏试剂(RMgBr)常用于有机合成,例如制备醇类化合物的合成路线如下:
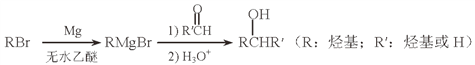
依据上述信息,写出制备![]() 所需醛的可能结构简式:_______________。
所需醛的可能结构简式:_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(题文)[化学——选修5:有机化学基础]
近来有报道,碘代化合物E与化合物H在Cr-Ni催化下可以发生偶联反应,合成一种多官能团的化合物Y,其合成路线如下:
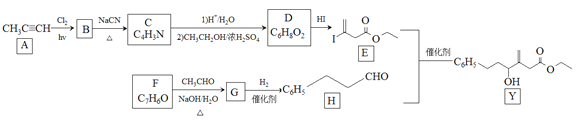
已知:![]()
回答下列问题:
(1)A的化学名称是________________。
(2)B为单氯代烃,由B生成C的化学方程式为________________。
(3)由A生成B、G生成H的反应类型分别是________________、________________。
(4)D的结构简式为________________。
(5)Y中含氧官能团的名称为________________。
(6)E与F在Cr-Ni催化下也可以发生偶联反应,产物的结构简式为________________。
(7)X与D互为同分异构体,且具有完全相同官能团。X的核磁共振氢谱显示三种不同化学环境的氢,其峰面积之比为3∶3∶2。写出3种符合上述条件的X的结构简式________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com