
【题目】已知![]() 可简写为
可简写为![]() 。现有某化合物W的分子结构可表示为:
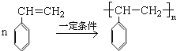
。现有某化合物W的分子结构可表示为:![]() 。
。
(1)W的分子式为___________;
(2)W的一氯代物有______种。
(3)下列有关W的说法不正确的是_______(填编号)。
a. 能发生还原反应 b. 能发生氧化反应 c. 能发生加聚反应
d. 等质量的W与苯分别完全燃烧所消耗的氧气量,前者大
(4)写出W的芳香族同分异构体(能发生聚合反应)的结构简式________,该聚合反应的化学方程式为__________________________________________________。
(5)W属于_____(填编号)。
a. 芳香烃 b. 环烃 c. 不饱和烃 d. 炔烃
【答案】C8H8 2 d 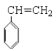
 bc
bc
【解析】
(1)根据W的结构简式书写分子式;
(2) ![]() 有2种等效氢;
有2种等效氢;
(3)根据W分子中含有碳碳双键分析性质;
(4) W的芳香族同分异构体(能发生聚合反应)的是苯乙烯;
(5)根据![]() 的结构分析;
的结构分析;
(1) W的结构简式是![]() ,
,![]() 的分子式是C8H8;
的分子式是C8H8;
(2) ![]() 有2种等效氢,
有2种等效氢,![]() 的一氯代物有2种;
的一氯代物有2种;
(3) ![]() 分子中含有碳碳双键, 能与氢气加成,发生还原反应;含有碳碳双键,能发生氧化反应;含有碳碳双键,能发生加聚反应;
分子中含有碳碳双键, 能与氢气加成,发生还原反应;含有碳碳双键,能发生氧化反应;含有碳碳双键,能发生加聚反应; ![]() 与苯中碳元素质量分数相同,所以等质量的W与苯分别完全燃烧所消耗的氧气量相等;不正确的是d。
与苯中碳元素质量分数相同,所以等质量的W与苯分别完全燃烧所消耗的氧气量相等;不正确的是d。
(4) W的芳香族同分异构体(能发生聚合反应)的是苯乙烯,结构简式是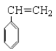 ;
; 一定条件下聚合为聚苯乙烯,反应的化学方程式为
一定条件下聚合为聚苯乙烯,反应的化学方程式为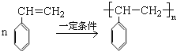 ;
;
(5) a. ![]() 不含苯环,不属于芳香烃,a错误;
不含苯环,不属于芳香烃,a错误;
b. ![]() 含有环状结构,属于环烃,b正确;
含有环状结构,属于环烃,b正确;
c. 含有碳碳双键,属于不饱和烃,c正确;
d. 不含碳碳叁键,不属于炔烃,d错误;
故合理选项为bc。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】把0.6molW气体和0.5molX气体混合于2L密闭容器中,使它们发生如下反应:4W(g)+3X(g)2Y(g)+nZ(g)。2min末已生成0.2molY,若测知以Z的浓度变化表示的反应速率为0.0025mol/(L·s),试计算:
(1)前2min内用W的浓度变化表示的平均反应速率为__。
(2)2min末时X的浓度为___。
(3)化学反应方程式中n=__。
(4)2min末,W的转化率__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期主族元素a、b、c、d、e的原子序数依次增大,A、B、C、D、E、F均是由上述元素组成的中学化学常见物质,其中A是四元化合物,C是能使湿润红色石蕊试纸变蓝的气体,D是淡黄色固体化合物,E是单质。各物质之间存在如图转化关系(部分产物未标出)。下列说法不正确的是
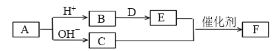
A.简单离子半径大小关系:c>d>e
B.简单阴离子的还原性:a>c>d
C.氢化物的沸点:c>d
D.C和E反应生成F是工业制硝酸的重要反应之一
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】资源化利用CO2,可以减少温室气体排放,还可以获得燃料或重要的化工产品。回答下列问题:
(1)CO2的捕集
①用饱和Na2CO3溶液做吸收剂可“捕集”CO2。写出“捕集”CO2反应的离子方式_____________。
②聚合离子液体是目前广泛研究的CO2吸附剂。结合图像分析聚合离子液体吸附CO2的有利条件是_________________________。
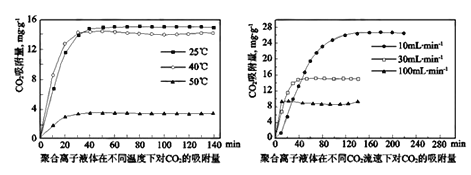
(2)生产尿素:
工业上以CO2、NH3为原料生产尿素[CO(NH2)2],该反应分为二步进行:
第一步:2NH3(g)+CO2(g)H2NCOONH4(s) △H = - 159.5 kJ·mol-1
第二步:H2NCOONH4(s)CO(NH2)2(s)+ H2O(g) △H = +116.5 kJ·mol-1
①写出上述合成尿素的热化学方程式___________________________。该反应化学平衡常数K的表达式:_________________________。
②某实验小组模拟工业上合成尿素,在一定体积的密闭容器中投入4mol NH3和1mol CO2,实验测得反应中各组分物质的量随时间的变化如图所示:
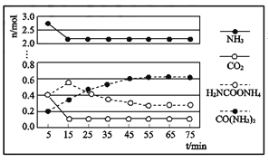
已知总反应的快慢由慢的一步反应决定,则合成尿素总反应的快慢由第__________步反应决定,总反应进行到___________min时到达平衡
(3)合成乙酸:中国科学家首次以CH3OH、CO2和H2为原料高效合成乙酸,其反应路径如图所示:
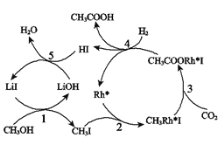
①原料中的CH3OH可通过电解法由CO2制取,用稀硫酸作电解质溶液,写出生成CH3OH的电极反应式_______________________。
②根据图示,写出总反应的化学方程___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙酸乙酯是重要的有机合成中间体,广泛应用于化学工业。实验室利用下图A装置制备乙酸乙酯。

(1)若实验中用乙酸和含18O的乙醇作用,该反应的化学方程式是:______.与教材采用的实验装置不同,此装置中采用了球形干燥管,其作用是______.
(2)为了证明浓硫酸在该反应中起到了催化剂和吸水剂的作用,某同学利用上图所示装置进行了以下4个实验.实验开始先用酒精灯微热3min,再加热使之微微沸腾3min.实验结束后充分振荡小试管Ⅱ再测有机层的厚度,实验记录如下:
实验编号 | 试管I中的试剂 | 试管II中的试剂 | 有机层的厚度/cm |
A | 2mL乙醇、1mL乙酸 1mL18molL-1浓硫酸 | 饱和Na2CO3 | 3.0 |
B | 2mL乙醇、1mL乙酸 | 0.1 | |
C | 2mL乙醇、1mL乙酸 3mL2molL-1H2SO4 | 0.6 | |
D | 2mL乙醇、1mL乙酸、盐酸 | 0.6 |
①实验D的目的是与实验C相对照,证明H+对酯化反应具有催化作用.实验D中应加入盐酸的体积和浓度分别是______mL和______molL-1。
②分析实验______(填实验编号)的数据,可以推测出浓H2SO4的吸水性提高了乙酸乙酯的产率。
(3)若现有乙酸90g,乙醇138g发生酯化反应得到88g乙酸乙酯,试计算该反应的产率为______。
(4)为充分利用反应物,甲、乙两位同学分别设计了如图甲、乙两个装置(乙同学待反应完毕冷却后,再用饱和碳酸钠溶液提取烧瓶中的产物).你认为最合理的是______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某人设计利用方案如下图所示:
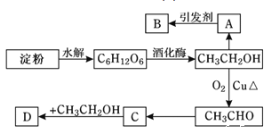
其中:A是水果催熟剂,B是高分子化合物,D是有水果香味的物质。
请回答以下问题:
(1)“C6H12O6”的结构简式是___________,C中原子团![]() 的名称是_______。
的名称是_______。
(2)写出下列转化的化学方程式及反应类型:
①A→B____________;反应类型______________。
②CH3CH2OH→CH3CHO_____________;反应类型____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有5种无色液态物质:己烯、己烷、苯、甲苯和苯酚符合下列各题要求的分别是:
(1)不与浓溴水反应但能与KMnO4酸性溶液反应的是_______。
(2)在空气中能被氧化成粉红色,该物质是_______。写出该物质与浓溴水反应的化学方程式________。
(3)不能与溴水和KMnO4酸性溶液反应,但在铁屑作用下能与液溴反应的是____,反应的化学方程式为________,此反应属于______反应。
(4)既能与溴水又能与KMnO4酸性溶液反应的烃是__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.按要求书写下列化学方程式和名称:
(1)1,3-丁二烯与等物质的量的单质溴在60℃时发生1,4-加成_________
(2)甲苯制备TNT_______,用系统命名给TNT命名________
(3)写出2-丙醇的消去反应化学方程式_________
Ⅱ.(1)某烃A的质谱图表明其相对分子质量为84,红外光谱表明分子中含有一个碳碳双键,与氢气加成反应可得到结构简式为(CH3)2CHCH(CH3)2的烷烃,则此烯烃可能的结构简式是:_____(任写一种)。
(2)核磁共振谱表明A分子中只有一种类型的氢。
①用系统命名法给A命名:_________。
②A中的碳原子是否都处于同一平面?________(填“是”或者“不是”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在三个体积均为2 L恒容密闭容器中,反应CO(g)+2H2(g)![]() CH3OH(g) ΔH<0达到平衡,得到如下数据。下列说法正确的是
CH3OH(g) ΔH<0达到平衡,得到如下数据。下列说法正确的是
容器编号 | 温度/K | 物质的起始物质的量/mol | 物质的平衡物质的量/mol | ||
CO(g) | H2(g) | CH3OH(g) | CH3OH(g) | ||
Ⅰ | T1 | 0.40 | 0.80 | 0 | 0.24 |
Ⅱ | T2 | 0 | 0 | 0.40 | 0.20 |
Ⅲ | T2 | a | b | ||
A.反应温度:T1<T2
B.达平衡时,转化率:α(CO,Ⅰ)+α(CH3OH,Ⅱ)>1
C.在容器Ⅲ中,若平衡时,CO的转化率大于H2,则![]()
D.在容器Ⅲ中,若起始时加入0.4 mol CO、0.4 mol H2和0.4 mol CH3OH,则此时v(正)>v(逆)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com