
【题目】催化剂是化工技术的核心,绝大多数的化工生产需采用催化工艺。
Ⅰ.(1)催化剂的选择性指在能发生多种反应的反应系统中,同一催化剂促进不同反应的程度的比较,实质上是反应系统中目的反应与副反应之间反应速度竞争的表现。如图所示为一定条件下![]() 与
与![]() 发生反应时,生成
发生反应时,生成![]() 、
、![]() 或
或![]() 的能量变化图[反应物
的能量变化图[反应物![]() 和生成物
和生成物![]() 略去]。在有催化剂作用下,
略去]。在有催化剂作用下,![]() 与
与![]() 反应主要生成____(选填“
反应主要生成____(选填“![]() 或
或![]() 或
或![]() ”)。
”)。
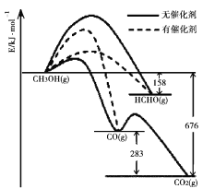
(2)2007年诺贝尔化学奖授予善于做“表面文章”的德国科学家哈德·埃特尔,他的成就之一是证实了气体在固体催化剂表面进行的反应,开创了表面化学的方法论。埃特尔研究的氮气和氢气分子在固体催化剂表面发生的部分变化过程如图所示:
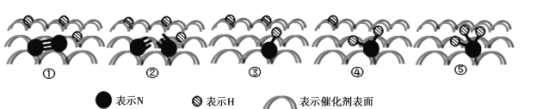
①下列说法不正确的是_________。
A.升高温度可以提高一段时间内![]() 的生产效率
的生产效率
B.图示中的②→③以及后面几个过程均是放热过程
C.此图示中存在![]() 键断裂和
键断裂和![]() 键断裂,以及
键断裂,以及![]() 键的形成过程
键的形成过程
②合成氨工业中,原料气(![]() 、
、![]() 及少量
及少量![]() 、
、![]() 的混合气)在进入合成塔前常用
的混合气)在进入合成塔前常用![]() (醋酸二氨合亚铜,
(醋酸二氨合亚铜,![]() 代表醋酸根)溶液来吸收原料气中的
代表醋酸根)溶液来吸收原料气中的![]() ,其反应是:
,其反应是:![]() ,生产中必须除去原料气中
,生产中必须除去原料气中![]() 的原因是_________;
的原因是_________;![]() 溶液吸收原料气中的
溶液吸收原料气中的![]() 的生产适宜条件应是____________。
的生产适宜条件应是____________。
Ⅱ.氮循环是指氮在自然界中的循环转化过程,是生物圈内基本的物质循环之一,存在较多蓝、绿藻类的酸性水体中存在如有图所示的氮循环,请回答相关问题。
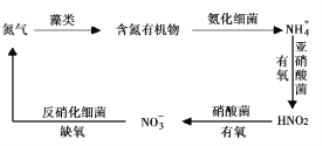
(3)![]() 硝化过程的方程式是
硝化过程的方程式是![]() ,恒温时在亚硝酸菌的作用下发生该反应,能说明体系达到平衡状态的是____(填标号)。
,恒温时在亚硝酸菌的作用下发生该反应,能说明体系达到平衡状态的是____(填标号)。
A.溶液的![]() 不再改变
不再改变
B.![]() 的消耗速率和
的消耗速率和![]() 的生成速率相等
的生成速率相等
C.溶液中![]() 、
、![]() 、
、![]() 的总物质的量保持不变
的总物质的量保持不变
实验测得在其它条件一定时,![]() 硝化反应的速率随温度变化曲线如下图A所示,温度高于35℃时反应速率迅速下降的原因可能是__________________。
硝化反应的速率随温度变化曲线如下图A所示,温度高于35℃时反应速率迅速下降的原因可能是__________________。

(4)亚硝酸盐含量过高对人和动植物都会造成直接或间接的危害,因此要对亚硝酸盐含量过高的废水进行处理。处理亚硝酸盐的方法之一是用次氯酸钠将亚硝酸盐氧化为硝酸盐,反应方程式是![]() 。在25℃和35℃下,分别向
。在25℃和35℃下,分别向![]() 初始浓度为
初始浓度为![]() 的溶液中按不同的投料比
的溶液中按不同的投料比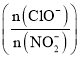 加入次氯酸钠固体(忽略溶液体积的变化),平衡时
加入次氯酸钠固体(忽略溶液体积的变化),平衡时![]() 的去除率和温度、投料比的关系如上图B所示,a、b、c、d四点
的去除率和温度、投料比的关系如上图B所示,a、b、c、d四点![]() 的转化率由小到大的顺序是______,35℃时该反应的平衡常数
的转化率由小到大的顺序是______,35℃时该反应的平衡常数![]() ______(保留三位有效数字)。
______(保留三位有效数字)。
【答案】![]() C 防止
C 防止![]() 使催化剂中毒 高压、低温 A 温度过高使亚硝酸菌失去活性 d、c、b、a 2.67
使催化剂中毒 高压、低温 A 温度过高使亚硝酸菌失去活性 d、c、b、a 2.67
【解析】
根据催化剂能降低反应的活化能,加快反应判断;根据化学反应的本质是反应物化学键断裂、生成物中化学键形成判断;结合催化剂的催化效率与温度有关解题;NH4+硝化过程的方程式是2NH4++3O22HNO3+2H2O+2H+,恒温时在亚硝酸菌的作用下发生该反应,能说明体系达到平衡状态的是正逆反应速率相同,个组分含量和浓度保持不变,温度高于35℃时反应速率迅速下降,说明催化剂亚硝酸菌失去生理活性;结合平衡常数的公式计算。
Ⅰ.(1)根据图象可以看出转化成甲醛时活化能最低,使用催化剂时主要产物为HCHO;
(2)①A.反应未达到平衡时,升高温度,可促进反应的进行,加快反应速率,可以提高一段时间内NH3的生产效率,故A正确;
B.图①→②为化学键的断裂过程,为吸热过程,图②→③为化学键的形成过程,为放热过程,后面是化学键形成过程为放热过程,故B正确;
C.图中分析可知包含反应物氮气化学键断裂,存在三键的断裂,N-H键的形成,不包含H-H键的断裂,故C错误;
故答案为C;
②生产中必须除去原料气中CO的原因是:防止CO使催化剂中毒,Cu(NH3)2Ac+CO+NH3[Cu(NH3)3]AcCO△H<0,反应为气体体积减小的放热反应,Cu(NH3)2Ac溶液吸收原料气中的CO的生产适宜条件应是:高压、低温,平衡正向进行;
(3)NH4+硝化过程的方程式是2NH4++3O22HNO3+2H2O+2H+,恒温时在亚硝酸菌的作用下发生该反应,能说明体系达到平衡状态的条件是正逆反应速率相同,个组分含量保持不变;
A.溶液的pH不再改变,说明微粒难度保持不变,说明反应达到平衡状态,故A正确;
B.速率之比等于化学方程式计量数之比,NH4+的消耗速率和H+的生成速率相等,只能说明平衡正向进行,不能说明反应达到平衡状态,故B错误;
C.元素守恒,溶液中NH4+、NH3H2O、HNO3、NO2-的总物质的量始终保持不变,不能说明反应达到平衡状态,故C错误;
故答案为:A;
实验测得在其它条件一定时,NH4+硝化反应的速率随温度变化曲线如图A所示,温度高于35℃时反应速率迅速下降的原因可能是:温度过高使亚硝酸菌失去活性;
(4)处理亚硝酸盐的方法之一是用次氯酸钠将亚硝酸盐氧化为硝酸盐,反应方程式是ClO-+NO2-═NO3-+Cl-.在25℃和35℃下,分别向NO2-初始浓度为5×10-3mol/L的溶液中按不同的投料比![]() 加入次氯酸钠固体(忽略溶液体积的变化),35°C平衡时NO2-的去除率80%,消耗NO2-的物质的量浓度=5×10-3mol/L×80%=0.004mol/L,投料比为2,则n(ClO-)=10-2mol/L,ab为相同温度下,cd为相同温度下,
加入次氯酸钠固体(忽略溶液体积的变化),35°C平衡时NO2-的去除率80%,消耗NO2-的物质的量浓度=5×10-3mol/L×80%=0.004mol/L,投料比为2,则n(ClO-)=10-2mol/L,ab为相同温度下,cd为相同温度下,![]() 比值越大,ClO-的转化率越小,则a、b、c、d四点ClO-的转化率由小到大的顺序是dcba;35℃时该反应:
比值越大,ClO-的转化率越小,则a、b、c、d四点ClO-的转化率由小到大的顺序是dcba;35℃时该反应:
此温度下的平衡常数K=![]() =2.67。
=2.67。


科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列叙述正确的是( )
A.6gSiO2晶体中含有的硅氧键数目为0.2NA
B.常温下pH=12的Na2CO3溶液中,由水电离出OH-的数目为0.01NA
C.常温常压下,10gD2O含有的质子数、电子数、中子数均为5NA
D.将含0.01molFeCl3的饱和溶液滴入沸水中可制得Fe(OH)3胶粒0.01NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,取浓度相同的NaOH和HCl溶液,以3∶2体积比相混合,所得溶液的pH等于12,则原溶液的浓度为
A.0.01mol·L-1B.0.017mol·L-1
C.0.05mol·L-1D.0.50mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】类比推理是化学中常用的思维方法。下列推理正确的是
A.![]() 晶体硅含
晶体硅含![]() 键的数目为
键的数目为![]() ,则
,则![]() 金刚砂含
金刚砂含![]() 键的数目也为
键的数目也为![]()
B.![]() 溶液中加入过量的
溶液中加入过量的![]() 溶液,发生化学反应的方程式:
溶液,发生化学反应的方程式:![]() ,则
,则![]() 溶液中加入过量的
溶液中加入过量的![]() 溶液,发生化学反应的方程式:
溶液,发生化学反应的方程式:![]()
C.标准状况下,![]() 中所含的分子数目为
中所含的分子数目为![]() 个,则
个,则![]() 中所含的分子数目也为
中所含的分子数目也为![]() 个
个
D.![]() 溶液中通入过量
溶液中通入过量![]() 发生了反应:
发生了反应:![]() ,则
,则![]() 溶液中通入过量
溶液中通入过量![]() 发生了:
发生了:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某工厂废水中含游离态氯,通过下列实验测定其浓度。
①取水样10.00mL于锥形瓶中,加入10.00mLKI溶液(足量),滴入指示剂2~3滴。
②取一只碱式滴定管依次用自来水、蒸馏水洗净,然后注入0.010mol·L-1Na2S2O3溶液,调整液面,记下读数。
③将锥形瓶置于滴定管下进行滴定,发生的反应为:I2+2Na2S2O3=2NaI+Na2S4O6。
试回答下列问题:
(1)步骤①加入的指示剂是___。
(2)滴定时,眼睛应注视___,判断到达滴定终点的现象是__,若耗去Na2S2O3溶液20.00mL,则废水中Cl2的物质的量浓度为___。
(3)实验中,Cl2的所测浓度比实际浓度偏大,造成误差的原因是___。
(4)如图表示50.00mL滴定管中液面的位置,若A与C刻度间相差1mL,A处的刻度为25.00mL,滴定管中液面读数应为___mL,设此时液体体积读数为amL,滴定管中液体的体积V___(50-a)mL(填“<”、“=”或“>”)。
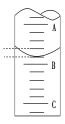
(5)滴定结束时俯视刻度线读取滴定终点时Na2S2O3溶液的体积,会导致测定结果__(填“偏大”、“偏小”或“不影响”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在25℃、101kPa的条件下,断裂1molH—H键吸收436kJ能量,断裂1molCl—Cl键吸收243kJ能量,形成1molH-Cl键放出431 kJ能量。H2+Cl2=2HCl的化学反应可用如图表示:
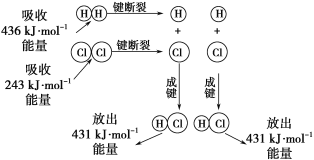
请回答下列有关问题:
(1)反应物断键吸收的总能量为___________________。
(2)生成物成键放出的总能量为______________。
(3)判断H2+Cl2=2HCl反应_____________(填“吸收”或“放出”)能量。
(4)反应物的总能量________(填“>”、“=”或“<”)生成物的总能量。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,对于某可逆反应中某一反应物从开始O点到达到平衡状态C点的过程的浓度变化情况。下列有关说法正确的是
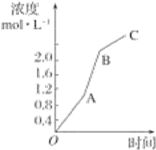
A.此可逆反应为A![]() B+C
B+C
B.反应过程中OA段的速率最快
C.反应过程中AB段的速率最快
D.反应过程中BC段的速率最快
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知某化学反应的平衡常数表达式为K=![]() ,在不同的温度下该反应的平衡常数如表所示:
,在不同的温度下该反应的平衡常数如表所示:
t/℃ | 700 | 800 | 830 | 1 000 | 1 200 |
K | 1.67 | 1.11 | 1.00 | 0.60 | 0.38 |
下列有关叙述不正确的是( )
A. 该反应的化学方程式是CO(g)+H2O(g)![]() CO2(g)+H2(g)
CO2(g)+H2(g)
B. 上述反应的正反应是放热反应
C. 若在1L的密闭容器中通入CO2和H2各1mol,5min后温度升高到830℃,此时测得CO2为0.4mol时,该反应达到平衡状态
D. 若平衡浓度符合下列关系式:![]() ,则此时的温度为1000℃
,则此时的温度为1000℃
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2019年8月13日中国科学家合成了首例缺陷诱导的晶态无机硼酸盐单一组分白光材料Ba2 [Sn(OH)6][B(OH)4] 2并获得了该化合物的LED器件,该研究结果有望为白光发射的设计和应用提供一个新的有效策略。
(1)基态Sn原子价层电子的空间运动状态有___种,基态氧原子的价层电子排布式不能表示为![]() ,因为这违背了____原理(规则)。
,因为这违背了____原理(规则)。
(2)[B(OH)4] -中氧原子的杂化轨道类型为____,[B(OH)4] -的空间构型为______。 [Sn(OH)6] 2-中,Sn与O之间的化学键不可能是___。
a ![]() 键 b σ键 c 配位键 d 极性键
键 b σ键 c 配位键 d 极性键
(3)碳酸钡、碳酸镁分解得到的金属氧化物中,熔点较低的是_____(填化学式),其原因是___________。
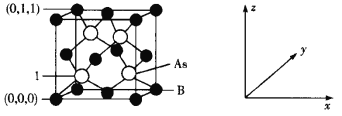
(4)超高热导率半导体材料——砷化硼(BAs)的晶胞结构如下图所示,则1号砷原子的坐标为____。已知阿伏加德罗常数的值为NA,若晶胞中As原子到B原子最近距离为a pm,则该晶体的密度为__g·cm-3(列出含a、NA的计算式即可)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com