
【题目】甲醇是重要的化工原料。利用合成气(主要成分为CO、CO2和H2)在催化剂的作用下合成甲醇,发生的主要反应如下:
① CO(g)+2H2(g)![]() CH3OH(g) ΔH1 =-99kJ·mol-1
CH3OH(g) ΔH1 =-99kJ·mol-1
② CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) ΔH2=-58 kJ·mol-1
CH3OH(g)+H2O(g) ΔH2=-58 kJ·mol-1
③ CO2(g)+H2(g)![]() CO(g)+H2O(g) ΔH3
CO(g)+H2O(g) ΔH3
(1)CO2的电子式是________________。
(2)ΔH3=______kJ·mol-1,②反应正向的熵变ΔS______0(填“>”“<”或“=”)。
(3)在容积为2 L的密闭容器中,充入一定量CO2和H2合成甲醇(上述②反应),在其他条件不变时,温度T1、T2对反应的影响图像如图。
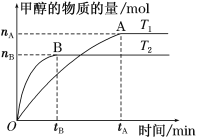
①温度为T1时,从反应到平衡,生成甲醇的平均速率为v(CH3OH)=_____ mol·L-1·min-1。
②图示的温度T1______T2(填写“>”、“<”或“=”)
(4)T1温度时,将2 mol CO2和6 mol H2充入2 L密闭容器中,充分反应(上述②反应)达到平衡后,若CO2转化率为50%,此时容器内的压强与起始压强之比为________;反应②在该温度达到平衡时,其平衡常数的数值为_______。
(5)若反应②在原电池条件下实现,请写出酸性条件下惰性电极上由CO2生成CH3OH的电极反应式:____________________,该电极为原电池的_______极。
【答案】![]() +41 <
+41 < ![]() < 3∶4 0.148~0.15(或1/6.75以及4/27 ) CO2 + 6e- + 6H+ = CH3OH + H2O 正
< 3∶4 0.148~0.15(或1/6.75以及4/27 ) CO2 + 6e- + 6H+ = CH3OH + H2O 正
【解析】
(1)CO2的电子式为![]() 。
。
(2)应用盖斯定律计算ΔH3。反应②正向的ΔS<0。
(3)①根据图像中数值用公式υ=![]() 计算υ(CH3OH)。
计算υ(CH3OH)。
②用“先拐先平”法分析,图像中T2先出现拐点,T2反应速率快,则T1<T2。
(4)用三段式和化学平衡常数的表达式计算。
(5)1molCO2得到6mol电子生成1molCH3OH,结合原子守恒、电荷守恒写电极反应式;该反应为还原反应,在原电池的正极上发生。
(1)CO2的电子式为![]() 。
。
(2)分析各热化学方程式,应用盖斯定律,将②-①得,CO2(g)+H2(g)![]() CO(g)+H2O(g)ΔH3=ΔH2-ΔH1=(-58kJ/mol)-(-99kJ/mol)=+41kJ/mol。反应②中气体反应物的化学计量数之和为4,气体生成物的化学计量数之和为2<4,反应②正向的ΔS<0。
CO(g)+H2O(g)ΔH3=ΔH2-ΔH1=(-58kJ/mol)-(-99kJ/mol)=+41kJ/mol。反应②中气体反应物的化学计量数之和为4,气体生成物的化学计量数之和为2<4,反应②正向的ΔS<0。
(3)①根据图像,温度为T1时,从反应到平衡反应生成CH3OH物质的量为nAmol,生成甲醇的平均速率为υ(CH3OH)=![]() mol/(L·min)=
mol/(L·min)=![]() mol/(L·min)。
mol/(L·min)。
②用“先拐先平”法分析,图像中T2先出现拐点,T2反应速率快,根据温度对化学反应速率的影响知:T1<T2。
(4)用三段式, CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g)
CH3OH(g)+H2O(g)
c(起始)(mol/L)1 3 0 0
c(转化)(mol/L)1×50%=0.5 1.5 0.5 0.5
c(平衡)(mol/L)0.5 1.5 0.5 0.5
在恒温恒容时气体压强之比等于气体物质的量之比,此时容器内的压强与起始压强之比为(0.5+1.5+0.5+0.5):(1+3)=3:4。该反应的平衡常数K=![]() =
=![]() =0.15。
=0.15。
(5)CO2中C元素的化合价为+4价,CH3OH中C元素的化合价为-2价,1molCO2得到6mol电子生成1molCH3OH,结合原子守恒、电荷守恒和酸性条件,CO2生成CH3OH的电极反应式为CO2+6e-+6H+=CH3OH+H2O,该反应为还原反应,该电极为原电池的正极。


 夺冠训练单元期末冲刺100分系列答案
夺冠训练单元期末冲刺100分系列答案 新思维小冠军100分作业本系列答案
新思维小冠军100分作业本系列答案 名师指导一卷通系列答案
名师指导一卷通系列答案科目:高中化学 来源: 题型:
【题目】(1)在微生物作用的条件下,NH4+经过两步反应被氧化成 NO3-。两步反应的能量变化示意图如下:
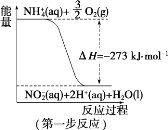

①第一步反应是_________________(填“放热”或“吸热”)反应,判断依据是___________。
②1 mol NH4+ (aq)全部氧化成NO3- (aq)的热化学方程式是_________________。
(2)已知红磷比白磷稳定,则反应 P4(白磷,s)+5O2(g)===2P2O5(s)ΔH1;4P(红磷,s)+ 5O2(g)===2P2O5(s)ΔH2;ΔH1 和 ΔH2 的关系是 ΔH1____________ΔH2(填“>”、“<”或“=”)。
(3)在 298 K、101 kPa 时,已知:2H2O(g)===O2(g)+2H2(g)ΔH1;Cl2(g)+H2(g)===2HCl(g) ΔH2;2Cl2(g)+2H2O(g)===4HCl(g)+O2(g)ΔH3
则 ΔH3 与 ΔH1 和 ΔH2 之间的关系正确的是___________。
A ΔH3=ΔH1+2 ΔH2 B ΔH3=ΔH1+ΔH2
C ΔH3=ΔH1-2ΔH2 D ΔH3=ΔH1-ΔH2
(4)已知 H2(g)+Br2(l)===2HBr(g)ΔH=-72 kJ·mol-1,蒸发 1 mol Br2(l)需要吸收的能量为 30 kJ,其他相关数据如下表:
物质 | H2(g) | Br2(g) | HBr(g) |
1 mol 分子中的化学键断裂时需要吸收的能量(kJ) | 436 | 200 | a |
则表中 a=__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是![]()
![]()
A. 气体摩尔体积就是![]()
B. 非标准状况下,1mol任何气体的体积不可能为![]()
C. 标准状况下![]() 任何物质都含有约
任何物质都含有约![]() 个分子
个分子
D. ![]() 和
和![]() 的混合气体在标准状况下的体积约
的混合气体在标准状况下的体积约![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常见锌锰干电池因含有汞、酸或碱等,废弃后进入环境将造成严重危害。某化学兴趣小组拟采用如下处理方法回收废电池中的各种资源。

(1)石墨中化学键类型为______________,在电池中的作用为_________________
(2) 酸性锌锰干电池的负极反应为_________________________
(3) 碱性锌锰干电池在放电过程产生MnOOH,写出正极反应式_____________
(4)填充物用60℃温水溶解,目的是_____________________。
(5)操作A的名称为______________。
(6)铜帽溶解时加入H2O2的目的是_______________________(用化学方程式表示)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】180℃时将0.5 mol H2和1 mol CO2通入2 L的恒容密闭容器中,此时容器内总压强为P0(已知分压=总压×物质的量分数),反应生成甲醇蒸汽(CH3OH)和H2O,测得各物质的物质的量随时间的部分变化如图所示,回答下列问题:
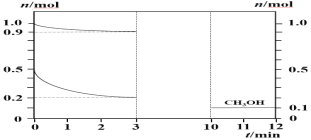
(1)该反应的化学方程式为:___________________
(2)在0~3 min内H2的平均化学反应速率为___________________
(3)0-1分钟的速率为V1,2-3分钟的速率为V2,10-11分钟的速率为V3,则V1、V2、V3由大到小的顺序为____________________________。
(4)3min内H2的转化率为______。
(5)平衡时,容器内的压强为__________,CO2的分压为____________(均保留2位有效数字)
(6)以(1)中反应设计成原电池(用硫酸作电解质溶液),则正极反应式为______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究发现,由钴氧化物负载的锰氧化物纳米粒子催化剂对某些反应具有高活性,应用前景良好。回答下列问题:
(1)Mn基态原子核外电子排布式为_____________。元素Mn与O中,第一电离能较大的是________;Mn与Co相比,基态原子核外未成对电子数较少的是_______。
(2)CO2和CH3OH分子中C原子的杂化形式分别为__________和__________。
(3)沸点相比较:
①甲醇____H2O(填写“>”“<”或“=”);原因是_____________________________;
②CO2____H2(填写“>”“<”或“=”);原因是________________________________。
(4)硝酸锰是制备上述反应催化剂的原料,Mn(NO3)2中的化学键除了π键外,还存在________。
(5)MgO具有NaCl型结构(如图),其中阴离子采用面心立方最密堆积方式,X射线衍射实验测得MgO的晶胞参数为αnm,则r(O2-)为________ nm (用含α的算式表示,不必运算化简,下同)。MnO也属于NaCl型结构,晶胞参数为αˊnm,则r(Mn2+)为________nm(用含α、αˊ的算式表示)。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在常温常压下,24mLH2S和O2的混合气体点燃后,生成6mLSO2,则原混合气体中H2S的体积可能为
A. 10mLB. 12mLC. 16mLD. 18mL
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com