
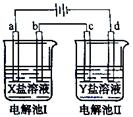
右图所示的电解池I和II中,a、b、c和d均为石墨电极。电解过程中,电极b和d上没有气体逸出,但质量均增大,且增重b﹤d。符合上述实验结果的盐溶液是( )
| 选项 | X | Y |
| A. | MgSO4 | CuSO4 |
| B. | AgNO3 | Pb(NO3)2 |
| C. | FeSO4 | Al2 (SO4)3 |
| D. | CuSO4 | AgNO3 |
科目:高中化学 来源: 题型:
常温下,将衡氨水与稀盐酸混合时,不可能出现的结果是 ( )
A.pH>7,c(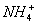 )+c(H+)=c(
)+c(H+)=c(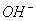 )+c(
)+c( )
)
B.pH<7,c(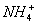 )+c(H+)=c(
)+c(H+)=c(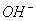 )+c(
)+c( )
)
C.pH=7,c(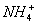 )> c(
)> c( )>c(H+)=c(
)>c(H+)=c(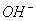 )
)
D.pH<7, c( )>c(
)>c(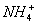 )> c(H+)>c(
)> c(H+)>c(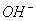 )
)
查看答案和解析>>
科目:高中化学 来源: 题型:
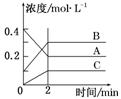
下图所示为800 ℃ 时A、B、C三种气体在密闭容器中反应时浓度的变化,只分析图形不能得出的结论是
A.A是反应物
B.前2 min A的分解速率为0.1 mol·L-1·min-1
C.达平衡后,若升高温度,平衡向正反应方向移动
D.反应的方程式为:2A(g)  2B(g) +C(g)
2B(g) +C(g)
查看答案和解析>>
科目:高中化学 来源: 题型:
生产自来水的流程如图所示:回答下列问题。
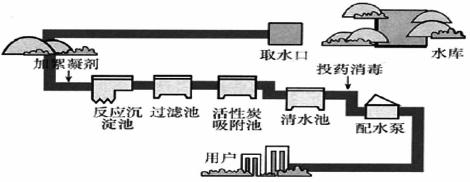
(1)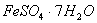 是常用的絮凝剂,它在水中最终生成__________沉淀(填化学式)。
是常用的絮凝剂,它在水中最终生成__________沉淀(填化学式)。
(2)天然水中含有较多的钙、镁离子,称为硬水。生活中常用__________方法来降低水的硬度。
(3)过滤池利用了实验室过滤原理,在实验室过滤操作所用到的玻璃仪器是__________。
(4)“投药消毒”中的“药”指漂白粉,请写出制取漂白粉的化学方程式__________。
(5)水的电离平衡曲线如图所示,若A点表示25℃时水的电离达平衡时的离子浓度,B点表示100℃时水的电离达平衡时的离子浓度。
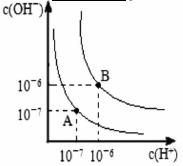
①100℃时1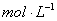 的NaOH溶液中,由水电离出的c(H+)=________
的NaOH溶液中,由水电离出的c(H+)=________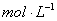 ,Kw(25℃)__________Kw(100℃)(填“>”“<”或“=”)。
,Kw(25℃)__________Kw(100℃)(填“>”“<”或“=”)。
②25℃时,向含100ml水的烧杯中逐渐加入一定量的冰醋酸,下列叙述正确的有__________(填字母)。
A. 溶液中一直存在: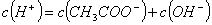
B. 加入过程中,水的电离程度逐渐减小,醋酸的电离程度逐渐增大
C. 加入过程中,溶液中所有离子浓度逐渐增大
D. 加完冰醋酸后,若升高烧杯温度,溶液pH值降低
E. 用已知浓度的NaOH溶液滴定烧杯中的醋酸溶液,测定其浓度,最好选用甲基橙作指示剂
查看答案和解析>>
科目:高中化学 来源: 题型:
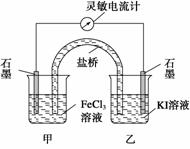
控制适合的条件,将反应2Fe3++2I- 2Fe2++I2设计成如右图所示的原电池。下列判断不正确的是( )
2Fe2++I2设计成如右图所示的原电池。下列判断不正确的是( )
A.反应开始时,乙中石墨电极上发生氧化反应
B.反应开始时,甲中石墨电极上的Fe3+被还原
C.电流计读数为零时,反应达到化学平衡状态
D.电流计读数为零后,在甲中溶入FeCl2固体,乙中的石墨电极为负极
查看答案和解析>>
科目:高中化学 来源: 题型:
已知反应①:CO(g)+CuO(s) CO2(g)+Cu(s)和反应②:H2(g)+CuO(s)
CO2(g)+Cu(s)和反应②:H2(g)+CuO(s) Cu(s)+H2O(g)在相同的某温度下的平衡常数分别为K1和K2,该温度下反应③:CO(g)+H2O(g)
Cu(s)+H2O(g)在相同的某温度下的平衡常数分别为K1和K2,该温度下反应③:CO(g)+H2O(g) CO2(g)+H2(g)的平衡常数为K。则下列说法正确的是( )
CO2(g)+H2(g)的平衡常数为K。则下列说法正确的是( )
A.反应①的平衡常数K1=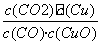
B.反应③的平衡常数K=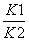
C.对于反应③,恒容时,温度升高,H2浓度减小,则该反应的△H>0
D.对于反应③,恒温恒容下,增大压强,H2浓度一定减小
查看答案和解析>>
科目:高中化学 来源: 题型:
⑴反应Fe(s)+CO2(g) FeO(s)+CO(g) △H1,平衡常数为K1;
FeO(s)+CO(g) △H1,平衡常数为K1;
反应Fe(s)+H2O(g) FeO(s)+H2(g) △H2,平衡常数为K2;在不同温度时K1、K2的值如下表:
FeO(s)+H2(g) △H2,平衡常数为K2;在不同温度时K1、K2的值如下表:
| 700℃ | 900℃ | |
| K1 | 1.47 | 2.15 |
| K2 | 2.38 | 1.67 |
①反应CO2(g) + H2(g) CO(g) + H2O(g) △H,平衡常数为K,则△H= (用△H1和△H2表示),K= (用K1和K2表示),且由上述计算可知,反应CO2(g) + H2(g)
CO(g) + H2O(g) △H,平衡常数为K,则△H= (用△H1和△H2表示),K= (用K1和K2表示),且由上述计算可知,反应CO2(g) + H2(g) CO(g) + H2O(g)是 反应(填“吸热”或“放热”)。
CO(g) + H2O(g)是 反应(填“吸热”或“放热”)。
②能判断CO2(g) + H2(g) CO(g) + H2O(g)达到化学平衡状态的依据是 (填序号)。
CO(g) + H2O(g)达到化学平衡状态的依据是 (填序号)。
A.容器中压强不变 B.混合气体中c(CO)不变
C.v正(H2)= v逆(H2O) D.c(CO)= c(CO2)
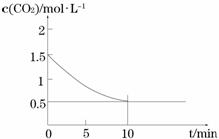 ⑵一定温度下,向某密闭容器中加入足量铁粉并充入一定量的CO2气体,发生反应Fe(s)+CO2(g)
⑵一定温度下,向某密闭容器中加入足量铁粉并充入一定量的CO2气体,发生反应Fe(s)+CO2(g) FeO(s)+CO(g) △H > 0,CO2的浓度与时间的关系如图所示。
FeO(s)+CO(g) △H > 0,CO2的浓度与时间的关系如图所示。
① 该条件下反应的平衡常数为 ;若铁粉足量,CO2的起始浓度为2.0 mol·L-1,则平衡时CO2的浓度为_________mol·L-1。
②下列措施中能使平衡时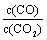 增大的是______(填序号)。
增大的是______(填序号)。
A.升高温度 B.增大压强
C.充入一定量的CO2 D.再加入一定量铁粉
查看答案和解析>>
科目:高中化学 来源: 题型:
已知A、B、C、D、E是中学化学中常见的五种化合物,它们分别由短周期两种元素组成,甲、乙、丙是单质,常温下甲、丙、A、C、D、E是气体,B为液体,乙为固体,①③必须在高温下反应才能发生。这些单质和化合物之间存在如下关系:
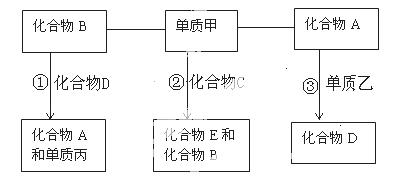
(1)写出甲的分子式 ; A的结构式 ;B的电子式 。
(2)若反应②是重要的工业反应,则该反应的化学方程式为 。
若反应②生成的化合物E具有漂白性,则该反应的化学方程式为 。
(3)1mol单质乙和1mol化合物B在高温下反应,生成1mol化合物D和1mol单质丙需吸收131.5kJ热量,写出其反应的热化学方程式: 。
(4)在密闭容器中,反应①是在高温下才能发生的可逆反应,其化学反应方程式为:
;反应达平衡后,若增大体系的压强,该平衡 (填向左移动,向右移动,不移动);其理由是: 。
查看答案和解析>>
科目:高中化学 来源: 题型:
工业上以铬铁矿(主要成分为FeO·Cr2O3)、碳酸钠、氧气和硫酸为原料生产重铬酸钠(Na2Cr2O7·2H2O),其主要反应为:
⑴4FeO·Cr2O3+8Na2CO3+7O2 
 8Na2CrO4+2Fe2O3+8CO2
8Na2CrO4+2Fe2O3+8CO2
⑵2Na2CrO4+H2SO4 Na2SO4+Na2Cr2O7+H2O
Na2SO4+Na2Cr2O7+H2O
下列说法中正确的是 ( )
A.反应⑴和⑵均为氧化还原反应
B.反应⑴的氧化剂是O2,还原剂是FeO·Cr2O3
C.高温下,O2的氧化性大于Fe2O3小于Na2CrO4
D.生成1mol的Na2Cr2O7时共转移7mol电子
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com