
【题目】暴露在空气中不易变质的物质是
A.小苏打 B.烧碱 C.FeSO4 D.Na2O2
科目:高中化学 来源: 题型:
【题目】下表为元素周期表的一部分,请参照元素①-⑨在表中的位置,回答问题:
族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
1 | ① | |||||||
2 | ② | ③ | ④ | |||||
3 | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ |
(1)表中用于半导体材料的元素在周期表中的位置是__________________。
(2)③、④、⑧的原子半径最小是___________________(用元素符号回答)。
(3)⑤、⑥、⑦的最高价氧化物对应的水化物,碱性最强的是__________(用化学式回答)。
(4)②、③、④的气态氢化物,稳定性最强的是__________(用结构式回答
(5)②和③按原子数1:2形成的化合物的电子式为____________,该晶体气化的过程中克
服的微粒间作用力为_______________________。
(6)③和⑧形成的化合物属于_______________(填“离子化合物”或“共价化合物”),该晶体属于________晶体(填“离子”、“分子”、“原子”)。
(7)元素⑤、⑦的最高价氧化物的水化物互相反应的化学方程式为:___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是( )
A. Si有导电性,可用于制备光导纤维
B. Na2O2能与CO2反应,可用作呼吸面具的供氧剂
C. 硅胶常用作实验室和食品、药品等的干燥剂,也可作催化剂载体
D. 小苏打是一种膨松剂,可用于制作馒头和面包
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】等电子体之间具有相似的结构和化学键类型。根据等电子原理,由短周期元素组成的粒子,只要其原子总数和原子最外层电子总数相同,均可互称为等电子体.下列各组粒子不能互称为等电子体的是
A.CO32-和NO3- B.O3和SO2
C.CO2和NO2- D.SCN-和N3-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于下列图示的说法中正确的是

A. 用图①所示实验可比较氯、碳、硅三种元素的非金属性强弱
B. 用图②所示实验装置通过排空气法收集CO气体
C. 图③所示装置可用于探究温度对H2O2分解反应速率的影响
D. 图④两个装置中通过导线的电子数相相同时,生成的H2的物质的量也相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是( )
A.化学反应中一定伴随能量变化
B.甲烷燃烧是将全部的化学能转化为热能
C.物质所含化学键键能越大,其越稳定
D.大量燃烧煤炭等化石燃料是造成雾霾天气的重要原因
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】
(1)烧杯间填满泡沫塑料的作用是 ;
(2)大烧杯上若不盖硬纸板,求得的中和热数值 (填“偏大”、 “偏小”、“无影响”)
(3)如下图所示,仪器A的名称是_______________;在实验过程中,如果不把温度计上的酸用水冲洗干净直接测量NaOH溶液的温度,则测得的△H -57.3KJ/mol(填“>”、“<”或“=”);

(4)实验中改用80mL 0.50mol/L盐酸跟100mL 0.55 mol/L NaOH溶液进行反应,与上述实验相比,所放出的热量 (填“相等、“不相等”),
所求中和热 (填“相等、“不相等”) 。
(5)用相同浓度和体积的氨水代替NaOH溶液进行上述实验,测得的中和热的数值会 ;(均填“偏大”、“偏小”、“无影响”)
(6)理论上稀强酸、稀强碱反应生成1mol水时放出57.3kJ的热量,写出稀硫酸和稀氢氧化钠溶液反应的中和热的热化学方程式 ;
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业生产中产生的SO2、NO直接排放将对大气造成严重污染.利用电化学原理吸收SO2和NO,同时获得 Na2S2O4和 NH4NO3产品的工艺流程图如下(Ce为铈元素).
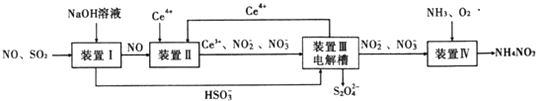
请回答下列问题.
(1)装置Ⅱ中NO在酸性条件下生成NO2-的离子方程式__________________;
(2)含硫各微粒(H2SO3、HSO3-和SO32-)存在于SO2与NaOH溶液反应后的溶液中,它们的物质的量分数ω与溶液pH的关系如图1所示

①下列说法正确的是 (填标号)。
A.pH=7时,溶液中c( Na+)<c (HSO3-)+c(SO32-)
B.由图中数据,可以估算出H2SO3的第二级电离平衡常数Ka2≈10-7
C.为获得尽可能纯的 NaHSO3,应将溶液的pH控制在 4~5为宜
D.pH=9时溶液中c(OH-)=c(H+)+c(HSO3-)+2c(H2SO3)
②若1L1mol/L的NaOH溶液完全吸收13.44L(标况下)SO2,则反应的总离子方程式为 。
③取装置Ⅰ中的吸收液vmL,用cmol/L的酸性高锰酸钾溶液滴定。酸性高锰酸钾溶液应装在 (填“酸式”或“碱式”)滴定管中,判断滴定终点的方法是 。
(3)装置Ⅲ 的作用之一是再生Ce4+ ,其原理如下图所示。

图中A为电源的 (填“正”或“负”)极。右侧反应室中发生的主要电极反应式为 。
(4) 已知进入装置Ⅳ的溶液中NO-2的浓度为 0.4 mol/L ,要使 1m3该溶液中的NO-2完全转化为 NH4NO3,需至少向装置Ⅳ中通入标准状况下的 O2的体积为 L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】
三硫化四磷是黄绿色针状结晶,其结构如图所示.不溶于冷水,溶于叠氮酸、二硫化碳、苯等有机济剂,在沸腾的NaOH稀溶液中会迅速水解。回答下列问题:

(1)Se是S的下一周期同主族元素,其核外电子排布式为_______。
(2)第一电离能:S____(填“>”或“<”,下同)P,电负性:S____P
(3)三硫化四磷分子中P原子采取______杂化,与PO3-互为等电子体的化合物分子的化学式为______。
(4)二硫化碳属______(填“极性”或“非极性”)分子。
(5)用NA表示阿伏伽德罗常数的数值,0.1mol三硫化四磷分子中含有的孤电子对数为____。
(6)纯叠氮酸(HN3)在常温下是一种液体,沸点较高,为308.8K,主要原因是________。
(7)氢氧化钠具有NaCl型结构,其晶胞中Na+与OH-之间的距离为acm ,晶胞中Na+的配位数为_______,用NA表示阿伏伽德罗常数的数值,NaOH的密度为_____g/cm3。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com