
| A. | 氮气的电子式: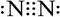 | B. | 镁离子的结构示意图: | ||
| C. | 中子数为16的磷原子:${\;}_{16}^{31}$P | D. | 丙烯的结构简式:CH3CHCH2 |
 学而优暑期衔接南京大学出版社系列答案
学而优暑期衔接南京大学出版社系列答案 Happy holiday欢乐假期暑假作业广东人民出版社系列答案
Happy holiday欢乐假期暑假作业广东人民出版社系列答案 快乐暑假暑假能力自测中西书局系列答案
快乐暑假暑假能力自测中西书局系列答案科目:高中化学 来源: 题型:选择题
| A. | 常温常压下,l.6g${\;}_{6}^{14}$CH4中含有共价键总数为0.4NA | |
| B. | 密闭容器中2molNO与1molO2充分反应后,容器内气体的分子数为2NA | |
| C. | 1 L 0.lmol•L-1的CH3COONa溶液中CH3COO-和CH3COOH粒子数之和为0.1NA | |
| D. | 过氧化钠与水反应时,生成0.1mol氧气转移的电子数为0.4NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH2=CH-CH=CH2 1,3-二丁烯 | |
| B. | CH3COOCH2CH2OOCCH3 乙二酸二乙酯 | |
| C. | CH3CH2CH(OH)CH3 3-丁醇 | |
| D. | 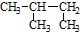 2-甲基丁烷 2-甲基丁烷 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
物理量 实验序号 | 0.1mol?L-1Fe2(SO4)3 的体积/mL | 30% H2O2 的体积/mL | H2O 的体积/mL |
| 1 | 0.5 | 15 | 24.5mL |
| 2 | 0.5 | 30 | 9.5 |
 N2O4(g),也是放热反应,升温使平衡向左移动,C(NO2)增大,颜色加深.
N2O4(g),也是放热反应,升温使平衡向左移动,C(NO2)增大,颜色加深.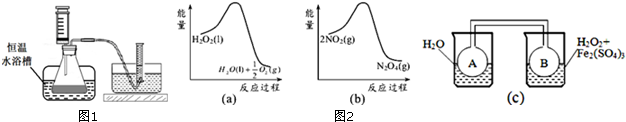
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
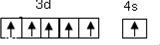 .
.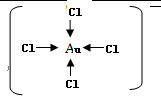 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
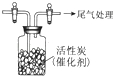 某学习小组推测SO2能与强氧化剂Cl2反应生成SO2Cl2,为此进行探究.
某学习小组推测SO2能与强氧化剂Cl2反应生成SO2Cl2,为此进行探究.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 获得新核素${\;}_{113}^{278}$Ja的过程,是一个化学变化 | |
| B. | 题中涉及的三种元素,都属于金属元素 | |
| C. | 这种超重核素${\;}_{113}^{278}$Ja的中子数与质子数只差为52 | |
| D. | 这种新核素,是同主族元素中原子半径最大的 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
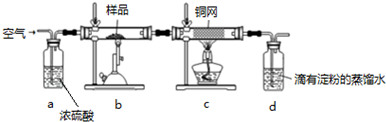
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com