
| A.某无色溶液中滴加BaCl2溶液出现白色沉淀,说明该无色溶液中一定含有SO42— |
| B.向2.0 mL浓度均为0.1 mol·L-1的KCl、KI混合溶液中滴加1~2滴0.01 mol·L-1AgNO3溶液,振荡,生成黄色沉淀,说明Ksp(AgI)比Ksp(AgCl)大 |
| C.铝箔在酒精灯火焰上加热熔化但不滴落,说明铝箔表面氧化铝膜熔点高于铝 |
| D.SO2、Cl2都能使品红试液褪色,其原理是相同的 |
 时刻准备着暑假作业原子能出版社系列答案
时刻准备着暑假作业原子能出版社系列答案 暑假衔接教材期末暑假预习武汉出版社系列答案
暑假衔接教材期末暑假预习武汉出版社系列答案 假期作业暑假成长乐园新疆青少年出版社系列答案
假期作业暑假成长乐园新疆青少年出版社系列答案科目:高中化学 来源:不详 题型:填空题
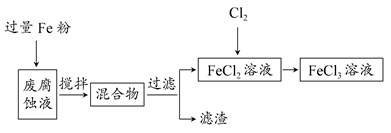

查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.常温下,浓硫酸、浓硝酸均能将金属铜氧化,且均能使铁钝化 |
| B.乙烯常用作植物催熟剂,乙酸常用作调味剂,乙醇常用于杀菌消毒 |
| C.玛瑙、水晶、钻石的主要成分均为SiO2 |
| D.蛋白质、纤维素、蔗糖、天然橡胶都是高分子化合物 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| 选项 | 操作 | 现象 | 结论 |
| A | 将浓硫酸滴到蔗糖表面 | 固体变黑膨胀 | 浓硫酸有脱水性和强氧化性 |
| B | 常温下将Al片放入浓硝酸中 | 无明显现象 | Al与浓硝酸不反应 |
| C | 将一小块Na放入无水乙醇中 | 产生气泡 | Na能置换出醇羟基中的氢 |
| D | 将水蒸气通过灼热的铁粉 | 粉末变红 | 铁与水在高温下发生反应 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.Na久置于空气中,可以和空气中的有关物质反应,最终生成NaHCO3 |
| B.在高温下用氢气还原MgCl2可制取金属镁 |
| C.实验测得NH4HCO3溶液显碱性,CH3COONH4溶液显中性,说明酸性:CH3COOH>H2CO3 |
| D.N2的化学性质通常非常稳定,但在放电条件下可以与O2反应生成NO2 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.除③外 | B.除②外 | C.除②③⑤外 | D.除②⑤外 |
查看答案和解析>>
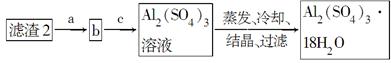
科目:高中化学 来源:不详 题型:填空题
| 物质 | Fe(OH)2 | Fe(OH)3 |
| Ksp/25 ℃ | 2.0×10-16 | 4.0×10-36 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题

| 沉淀物 | Fe(OH)3 | Al(OH)3 | Cu(OH)2 |
| 沉淀开始时pH | 2.7 | 4.1 | 8.3 |
| 沉淀完全时pH | 3.7 | 5.4 | 9.8 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com