
分析 (1)1mL0.05mol/L的H2SO4溶液中氢离子浓度为0.1mol/L,加水稀释至100mL后,溶液体积变为100倍,则氢离子浓度变为原来的$\frac{1}{100}$;稀释过程中硫酸的物质的量不变,当溶液接近中性时要考虑水的电离,所以将pH=5的硫酸溶液稀释500倍后,溶液中的SO42-的浓度成比例下降,但H+浓度降到10-7mol/L便不再下降;
(2)0.01mol•L-1的NaOH溶液中氢氧根浓度为0.01mol/L,而pH为11,即氢离子浓度为10-11mol/L,则可知该温度下水的离子积Kw=10-13,将0.01mol•L-1的NaOH溶液与pH=5的盐酸等体积混合后,溶液显碱性,根据c(OH-)=$\frac{n(O{H}^{-})-n({H}^{+})}{{V}_{混}}$来计算;
(3)pH=5的H2SO4的溶液中由水电离出的H+浓度为c1=$\frac{1{0}^{-14}}{1{0}^{-5}}$=10-9mol/L,pH=5的Al2(SO4)3溶液溶液中由水电离出的H+浓度为c2=10-5mol/L;
(4)若所得混合溶液呈中性,aL×0.1mol/L=bL×0.001mol/L;若所得混合溶液pH=12,则碱过量,所以$\frac{a×0.1-b×0.001}{a+b}$=0.01mol/L.
解答 解:(1)1mL0.05mol/L的H2SO4溶液中氢离子浓度为0.1mol/L,加水稀释至100mL后,溶液体积变为100倍,则氢离子浓度变为原来的$\frac{1}{100}$,即稀释后氢离子浓度为10-3mol/L,则pH=3;pH为5的溶液中氢离子浓度为:c(H+)=1×10-5mol/L,硫酸根离子的浓度为:c(SO42-)=5×10-6mol/L,
溶液稀释500倍后,氢离子浓度不可能小于1×10-7mol/L,只能无限接近1×10-7mol/L,而硫酸根离子浓度为:c(SO42-)=1×10-8mol/L,
所以稀释后溶液中硫酸根离子与氢离子浓度之比为:1×10-8mol/L:1×10-7mol/L=1:10.
故答案为:3;1:10;
(2)0.01mol•L-1的NaOH溶液中氢氧根浓度为0.01mol/L,而pH为11,即氢离子浓度为10-11mol/L,则可知该温度下水的离子积Kw=10-13.将0.01mol•L-1的NaOH溶液与pH=5的盐酸等体积混合后,氢氧化钠过量,溶液显碱性,故混合溶液中c(OH-)=$\frac{n(O{H}^{-})-n({H}^{+})}{{V}_{混}}$=$\frac{0.01mol/L×VL-1{0}^{-5}mol/L×VL}{2VL}$≈5×10-3mol/L,则溶液中c(H+)=$\frac{1{0}^{-13}}{5×1{0}^{-3}}$=2×10-11mol/L,则pH=-lg2×10-11=10.7,故答案为:10.7;
(3)硫酸溶液中的氢氧根离子、硫酸铝溶液中的氢离子是水电离的,pH=5的硫酸溶液中由水电离出的H+浓度为c1=$\frac{1{0}^{-14}}{1{0}^{-5}}$=10-9mol/L,pH=5的Al2(SO4)3溶液中由水电离出的H+浓度为c2=10-5mol/L,则c1:c2=10-9mol/L:10-5mol/L=1:10000,
故答案为:1:10000;
(4)若所得混合溶液呈中性,则硫酸中的氢离子与氢氧化钡的氢氧根离子的物质的量相等,即:aL×0.1mol/L=bL×0.001mol/L,解得a:b=1:100;
若所得混合溶液pH=12,溶液显示碱性,碱过量,则:$\frac{a×0.1-b×0.001}{a+b}$=0.01mol/L,解得a:b=11:90,
故答案为:1:100;11:90.
点评 本题考查酸碱混合pH的计算、水的电离及其影响因素,明确浓度与pH的换算、酸碱混合溶液为中性、碱性时离子浓度的关系等是解答本题的关键,题目难度中等.


科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
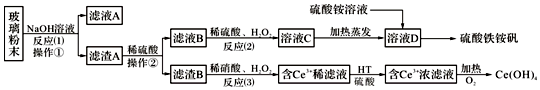
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 硅胶作袋装食品的干燥剂没有发生化学变化 | |
| B. | 碳纤维是一种新开发的材料,它属于合成有机高分子化合物 | |
| C. | Al2O3用作耐火材料,Al(OH)3用作阻燃剂 | |
| D. | 小苏打是治疗胃酸过多的一种药剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
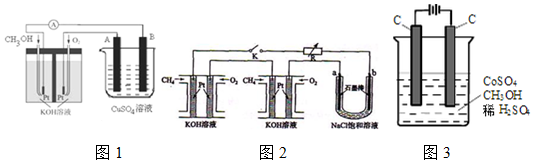
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com