
| A. | 1mol冰中有4NA个氢键 | |
| B. | 12克石墨中C---C键为2NA | |
| C. | 氯化钠晶体中,每个Na+周围距离相等的Na+共有6个 | |
| D. | 六方最密堆积中,每个原子的配位数是12 |
分析 A.每个H2O分子通过氢键与4个H2O分子结合,则平均每个H2O分子含有氢键数目为4×$\frac{1}{2}$=2个;
B.石墨中每个C原子与其它3个C原子成键,则平均每个C原子成键数目为3×$\frac{1}{2}$=1.5个;
C.氯化钠晶体中Na+或Cl-的配位数都是6,而每个Na+周围距离相等的Na+共有12个;
D.各种最密堆积中,六方最密堆积是有对称性的一种,这种堆积方式是金属晶体的最密堆积,配位数是12,空间利用率较高,约74%.
解答 解:A.每个H2O分子通过氢键与4个H2O分子结合,平均每个H2O分子含有氢键数目为4×$\frac{1}{2}$=2个,故1mol冰中有2mol氢键,故A错误;
B.1个C原子对应3×$\frac{1}{2}$=$\frac{3}{2}$个C-C键,所以12克石墨中C-C键为3NA,故B错误;
C.氯化钠晶体中Na+或Cl-的配位数都是6,所以在NaCl晶体中每个Na+(或C1-)周围都紧邻6个Cl-(或Na+),而每个Na+周围距离相等的Na+共有12个,故C错误;
D.各种最密堆积中,六方最密堆积是有对称性的一种,每个原子的配位数是12,故D正确;
故选D;
点评 本题主要考查物质中氢键、化学键的计算、晶胞分析,注意把握晶体结构、离子占据的位置是解答的关键,学生具有较好的空间想象能力即可解答,题目难度中等.


科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 序号 | 实验操作 | 现象 |
① | 向大试管中加入20mL 0.1mol?L-1的Na2S溶液 (已知Na2S溶液显碱性,pH约为12),再滴加5mL 0.1mol?L-1的FeCl3溶液,边滴边振荡 | 产生大量黑色沉淀,反应后溶液仍显碱性 |
② | 向另一支大试管中加入20mL 0.1mol?L-1FeCl3溶液(已知FeCl3溶液显酸性,pH约为2),再滴加5mL 0.1mol?L-1的Na2S溶液,边滴边振荡 | 局部有黑色沉淀但瞬间消失,溶液颜色变浅,并产生大量黄色浑浊,反应后溶液仍显酸性 |
| 实验操作 | 预期现象和结论 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 实验室需要0.1mol/LNaOH溶液450mL和0.5mol/L的硫酸溶液500mL.根据这两种溶液的配制情况回答下列问题.
实验室需要0.1mol/LNaOH溶液450mL和0.5mol/L的硫酸溶液500mL.根据这两种溶液的配制情况回答下列问题.查看答案和解析>>
科目:高中化学 来源: 题型:解答题


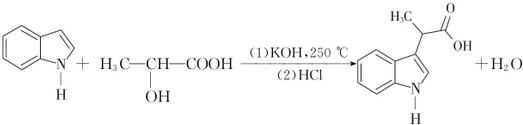
 .
. .
. (填结构简式).
(填结构简式). 经如下步骤合成:
经如下步骤合成:
 的反应类型为还原反应,反应条件2为催化剂、加热,其反应的化学方程式为
的反应类型为还原反应,反应条件2为催化剂、加热,其反应的化学方程式为 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 ;②中离子方程式为Br-+Ag+═AgBr↓;
;②中离子方程式为Br-+Ag+═AgBr↓; 、Br2,要想得到纯净的产物,可用NaOH溶液(或水)试剂洗涤,洗涤后分离粗产品应使用的仪器是分液漏斗;
、Br2,要想得到纯净的产物,可用NaOH溶液(或水)试剂洗涤,洗涤后分离粗产品应使用的仪器是分液漏斗; ;
;查看答案和解析>>
科目:高中化学 来源: 题型:解答题


查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com