
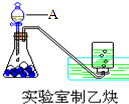
 (1)实验室制取乙炔的实验装置图(如图)中,A仪器的名称为分液漏斗;所盛的试剂为饱和食盐水.发生反应的化学方程式为:CaC2+2H2O→Ca(OH)2+CH≡CH↑.
(1)实验室制取乙炔的实验装置图(如图)中,A仪器的名称为分液漏斗;所盛的试剂为饱和食盐水.发生反应的化学方程式为:CaC2+2H2O→Ca(OH)2+CH≡CH↑.分析 (1)依据实验室常见仪器回答;电石与水反应速率较快,一般用饱和食盐水代替水制取,电石与水反应生成乙炔和氢氧化钙,据此书写化学反应方程式;
(2)乙炔中含有碳碳三键,能与高锰酸钾溶液反应使其褪色;1mol乙炔与1mol溴发生加成反应生成1,2-二溴乙烷;
(3)硫化氢和硫酸铜反应生成沉淀,磷化氢易溶于水,据此解答即可.
解答 解:(1)仪器A为分液漏斗,锥形瓶中盛放电石,由于电石与水反应太快,故利用饱和食盐水代替水,反应方程式为:CaC2+2H2O→Ca(OH)2+CH≡CH↑,
故答案为:分液漏斗;饱和食盐水;CaC2+2H2O→Ca(OH)2+CH≡CH↑;
(2)乙炔与酸性高锰酸钾溶液反应,高锰酸钾溶液紫色褪去,1mol乙炔与1mol溴反应生成1,2-二溴乙烷,反应方程式为:CH≡CH+Br2→CHBr═CHBr,
故答案为:CH≡CH+Br2→CHBr═CHBr;
(3)硫化氢和硫酸铜反应生成沉淀,磷化氢易溶于水,可用硫酸铜除去,故答案为:将混合气体通过CuSO4溶液(或NaOH溶液)洗气.
点评 本题主要考查的是乙炔的制取以及物质的分离与提纯,涉及化学反应方程式的书写,难度不大.


 第三学期赢在暑假系列答案
第三学期赢在暑假系列答案 学练快车道快乐假期暑假作业新疆人民出版社系列答案
学练快车道快乐假期暑假作业新疆人民出版社系列答案科目:高中化学 来源: 题型:选择题
| A. | 3:1 | B. | 1:3 | C. | 2:3 | D. | 3:2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | [Ne]3s1[Ne]3s2 | B. | [Ar]4s1[Ne]3s23p4 | ||
| C. | [Ne]3s2[Ar]4s2 | D. | [He]2s22p4[Ne]3s23p5 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | R位于元素周期表中的第VA族 | B. | R位于元素周期表中的第 VIIA族 | ||
| C. | RO3-中的R元素只能被还原 | D. | R2在常温常压下一定是气体 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
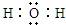 ,C和D形成的一种化合物与A2C发生氧化还原反应,该反应的离子方程式为2Na2O2+2H2O═4Na++4OH-+O2↑
,C和D形成的一种化合物与A2C发生氧化还原反应,该反应的离子方程式为2Na2O2+2H2O═4Na++4OH-+O2↑查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com