
| A. | HOCH2CH=CH2能发生取代反应,加成反应、氧化反应 | |
| B. | 月桂烯(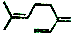 )所有碳原子一定在同一平面上 )所有碳原子一定在同一平面上 | |
| C. | 甲烷、乙烯、苯和乙醇都能使酸性KMnO4溶液褪色 | |
| D. | 油脂皂化反应得到高级脂肪酸与甘油 |
分析 A.HOCH2CH=CH2中含-OH、碳碳双键,结合醇、烯烃的性质分析;
B. 中2个双键之间的C为四面体构型;
中2个双键之间的C为四面体构型;
C.甲烷、苯与高锰酸钾不反应;
D.油脂在碱性条件下的水解反应为皂化反应.
解答 解:A.HOCH2CH=CH2中含-OH可发生取代反应、氧化反应,含碳碳双键可发生加成反应、氧化反应,故A正确;
B. 中2个双键之间的C为四面体构型,则所有碳原子不一定共面,故B错误;
中2个双键之间的C为四面体构型,则所有碳原子不一定共面,故B错误;
C.甲烷、苯与高锰酸钾不反应,而乙烯、乙醇都能使酸性KMnO4溶液褪色,故C错误;
D.油脂在碱性条件下的水解反应为皂化反应,油脂皂化反应得到高级脂肪盐与甘油,故D错误;
故选A.
点评 本题考查有机物的结构与性质,为高频考点,把握官能团与性质的关系、有机反应为解答的关键,侧重分析与应用能力的考查,注意选项B为解答的难点,题目难度不大.


科目:高中化学 来源: 题型:解答题


| 温度/℃ | 30 | 35 | 40 | 45 | 50 |
| TiO2•xH2O转化率/% | 92 | 95 | 97 | 93 | 88 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
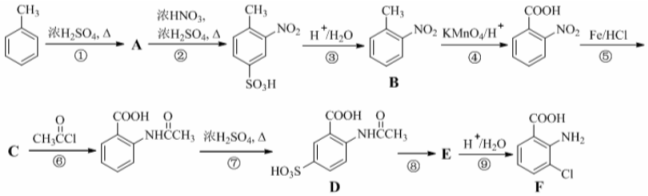

 分子中不同化学环境的氢原子共有4种,共面原子数目最多为13.
分子中不同化学环境的氢原子共有4种,共面原子数目最多为13. .
. ,该步反应的主要目的是保护氨基.
,该步反应的主要目的是保护氨基.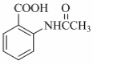 为主要原料,经最少步骤制备含肽键聚合物的流程.
为主要原料,经最少步骤制备含肽键聚合物的流程.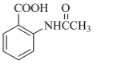 …$→_{反应条件}^{反应试剂}$目标化合物 …$→_{反应条件}^{反应试剂}$目标化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 煤的干馏和石油的分馏都是物理变化 | |
| B. | 1-氯丙烷和2-氯丙烷的消去产物相同 | |
| C. | 正戊烷、异戊烷、新戊烷的沸点逐渐升高 | |
| D. | 除去苯中苯酚,加入溴水后过滤 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
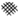 ”阴影描绘出CO降解率随温度变化的曲线可能出现的最大区域范围
”阴影描绘出CO降解率随温度变化的曲线可能出现的最大区域范围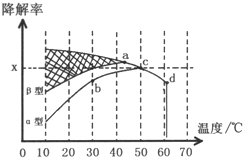 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 石油液化气的主要成份为甲烷 | |
| B. | 燃料的脱硫、脱氮都是减少酸雨产生的措施 | |
| C. | BaSO4难溶于水是弱电解质,在医学上用作钡餐 | |
| D. | 磨豆浆的大豆富含蛋白质,豆浆煮沸后蛋白质变成了氨基酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 反应N2 (g)+3H2 (g)?2NH3 (g)的△H<0,△S>0 | |
| B. | 地下钢铁管道用导线连接锌块可以减缓管道的腐蚀 | |
| C. | 常温下,Ksp[Mg(OH)2]=5.6×10-12,pH=10的含Mg2+溶液中,c(Mg2+ )≤5.6×10-4 mol•L-1 | |
| D. | 常温常压下,锌与稀H2SO4反应生成11.2 L H2,反应中转移的电子数为6.02×1023 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Ba(OH)2•8H2O与NH4Cl的反应 | B. | NaOH溶液与盐酸的反应 | ||
| C. | 甲烷与氧气的反应 | D. | 石灰石的分解反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
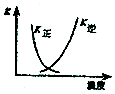 A.2SO2(g)+O2(g)?2SO3(g)△H<0 |  B.25℃时,用0.1mol/L盐酸滴定20mL0.1mol/LNaOH溶液 |
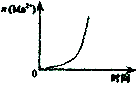 C.酸性KmnO4溶于与过量的H2C2O4溶液混合 |  D.CH2=CH2(g)+H2(g)→CH3CH3(g)△H>0,使用催化剂(a)和未使用催化剂(b) |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com