
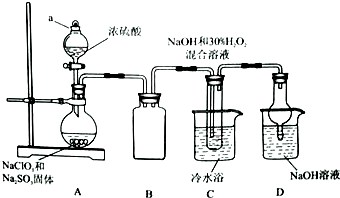
 实验室欲制备高效漂白剂亚氯酸钠(NaCLO2),并对其样品进行分析.
实验室欲制备高效漂白剂亚氯酸钠(NaCLO2),并对其样品进行分析.分析 根据装置图可知,装置A中用浓硫酸、NaClO3、Na2SO3混合反应生成ClO2气体,装置B作安全瓶,可防止倒吸,装置C中用ClO2与NaOH溶液和H2O2一起反应生成NaClO2,由于高于60℃时析出NaClO2分解,所以要用冷水浴进行冷却,装置D 用氢氧化钠吸收实验中的尾气,同时可以防止倒吸,
(1)根据装置图可知仪器a的名称;
(2)在NaOH溶液中,ClO2被H2O2还原成NaClO2,H2O2被氧化成O2,根据电荷守恒和元素守恒书写离子方程式;
(3)根据上面的分析可知,装置D的作用是吸收实验中的尾气,同时可以防止倒吸;
(4)由于NaClO2饱和溶液在低于38℃时析出NaClO2•3H2O,高于38℃时析出NaClO2,要得到NaClO2晶体,在55℃蒸发结晶、趁热过滤后用高于38℃低于60℃的热水洗涤,再低于60℃干燥即可;
(5)根据题意,NaClO2在酸性条件下将碘离子氧化成碘单质,根据电子得失守恒有关系式NaClO2~2I2,再用Na2S2O3滴定生成 的碘,根据Na2S2O3的物质的量可计算出NaClO2的物质的量,进而确定NaClO2的质量分数.
解答 解:根据装置图可知,装置A中用浓硫酸、NaClO3、Na2SO3混合反应生成ClO2气体,装置B作安全瓶,可防止倒吸,装置C中用ClO2与NaOH溶液和H2O2一起反应生成NaClO2,由于高于60℃时析出NaClO2分解,所以要用冷水浴进行冷却,装置D 用氢氧化钠吸收实验中的尾气,同时可以防止倒吸,
(1)根据装置图可知仪器a的名称是分液漏斗,
故答案为:分液漏斗;
(2)在NaOH溶液中,ClO2被H2O2还原成NaClO2,H2O2被氧化成O2,反应的离子方程式为2ClO2+H2O2+2OH-=2ClO2-+2H2O+O2 ,
故答案为:2ClO2+H2O2+2OH-=2ClO2-+2H2O+O2;
(3)根据上面的分析可知,装置D的作用是吸收实验中的尾气,同时可以防止倒吸,
故答案为:吸收实验中的尾气,同时可以防止倒吸;
(4)由于NaClO2饱和溶液在低于38℃时析出NaClO2•3H2O,高于38℃时析出NaClO2,要得到NaClO2晶体,在55℃蒸发结晶、趁热过滤后用高于38℃低于60℃的热水洗涤,再低于60℃干燥即可,
故答案为:用高于38℃低于60℃的热水洗涤;
(5)根据题意,NaClO2在酸性条件下将碘离子氧化成碘单质,根据电子得失守恒有关系式NaClO2~2I2,再用Na2S2O3滴定生成 的碘,根据反应2S2O32-+I3-═S4O62-+3I-,可得关系式为NaClO2~2I2~4S2O32-,Na2S2O3的物质的量为cv×10-3 mol,则NaClO2的物质的量为$\frac{1}{4}$×cv×10-3 mol,所以NaClO2的质量分数为$\frac{\frac{1}{4}×cv×10{\;}^{-3}×\frac{250}{25}×(23+35.5+32)g}{Wg}$×100%=$\frac{22.63cv}{w}$%,
故答案为:$\frac{22.63cv}{w}$%.
点评 本题考查亚氯酸钠制备实验的基本操作、亚氯酸钠的性质及中和滴定等知识,理解原理是解题的关键,同时考查学生分析问题、解决问题的能力,题目难度中等.


科目:高中化学 来源: 题型:多选题
| A. | 与水反应中既是氧化剂又是还原剂 | B. | 与NaOH反应生成溴化钠和次碘酸钠 | ||
| C. | 可作氧化剂 | D. | 与水反应是氧化还原反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 23g/L | B. | 27.2g/L | C. | 29.25g/L | D. | 32.4g/L |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①④ | B. | ② | C. | ②③ | D. | ⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 存在 2,2-二甲基-3-戊炔 | |
| B. | 月桂烯分子中( 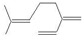 )所有碳原子一定在同一平面上 )所有碳原子一定在同一平面上 | |
| C. | CF2Cl2存在两种同分异构体 | |
| D. | 用红外光谱法可鉴别二甲醚和乙醇 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com