

| A. | 气体1可能为NO和CO2的混合物 | |
| B. | 沉淀3可能为Mg(OH)2和Al(OH)3的混合物 | |
| C. | 沉淀4可能为BaCO3、BaSO3或二者混合物 | |
| D. | X中一定有K2SO3,可能有KAlO2 |
分析 固体X中加入过量的硝酸,得溶液2,加入氯化钡生成沉淀4,说明固体中含有K2SO3,加入稀硝酸还有气体生成,则一定含有Na2CO3,向溶液2中加入氨水有沉淀生成,沉淀可能是Mg(OH)2和Al(OH)3的混合物;
所以固体中一定含有K2SO3、Na2CO3,可能含有Mg(OH)2和Al(OH)3中的一种或两种,
A、稀硝酸的强氧化性,气体1不可能为SO2;
B、沉淀3为Al(OH)3或Mg(OH)2或二者都有;
C、能和氯化钡反应产生的不溶于硝酸的白色沉淀是硫酸钡;
D、固体粉末X中一定有K2SO3,可能有KAlO2.
解答 解:固体X中加入过量的硝酸,得溶液2,加入氯化钡生成沉淀4,说明固体中含有K2SO3,加入稀硝酸还有气体生成,则一定含有Na2CO3,向溶液2中加入氨水有沉淀生成,沉淀可能是Mg(OH)2和Al(OH)3的混合物;所以固体中一定含有K2SO3、Na2CO3,可能含有Mg(OH)2和Al(OH)3中的一种或两种,
A、稀硝酸的强氧化性,气体1不可能为SO2,两者要发生氧化还原反应,气体1可能为NO和CO2的混合物,故A正确;
B、沉淀3为Al(OH)3或Mg(OH)2或二者都有,故B正确;
C、沉淀4可为BaSO4,故C错误;
D、固体粉末X中一定有K2SO3,可能有KAlO2,故D正确;
故选C.
点评 解此类题,离子的共存问题方面进行分析,熟练掌握常见的盐的性质,而不溶于硝酸的白色沉淀只有硫酸钡和氯化银两种物质是解题的关键


科目:高中化学 来源:2016-2017学年湖南省高二上第三次月考化学卷(解析版) 题型:填空题
短周期主族元素A、B、C、D、E原子序数依次增大,A是周期表中原子半径最小的元素,B是形成化合物种类最多的元素,C原子的最外层电子数是次外层电子数的3倍,D是同周期中金属性最强的元素,E的负一价离子与C的某种氢化物分子含有相同的电子数.
(1)A、C、D形成的化合物中含有的化学键类型为 .
(2)已知:
①E﹣E→2E△H=+a kJ•mol﹣1;
②2A→A﹣A△H=﹣b kJ•mol﹣1;
③E+A→A﹣E△H=﹣c kJ•mol﹣1;
写出298K时,A2与E2反应的热化学方程式 .
(3)在某温度下、容积均为2L的三个密闭容器中,按不同方式投入反应物,保持恒温恒容,使之发生反应:2A2(g)+BC(g)?X(g)△H=﹣a kJ•mol﹣1(a>0,X为A、B、C三种元素组成的一种化合物).初始投料与各容器达到平衡时的有关数据如下:
实验 | 甲 | 乙 | 丙 |
初始投料 | 2molA2、1molBC | 1molX | 4molA2、2molBC |
平衡时n(X) | 0.5mol | n2 | n3 |
反应的能量变化 | 放出Q1kJ | 吸收Q2kJ | 放出Q3kJ |
体系的压强 | P1 | P2 | P3 |
反应物的转化率 | α1 | α2 | α3 |
①在该温度下,假设甲容器从反应开始到平衡所需时间为4min,则A2的平均反应速率v(A2)= .
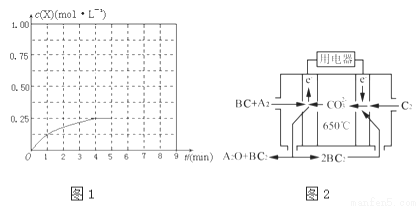
②计算该温度下此反应的平衡常数K= .
③三个容器中的反应分别达平衡时各组数据关系正确的是 (填字母).
A.α1+α2=1
B.Q1+Q2=a
C.α3<α1
D.P3<2P1=2P2
E.n2<n3<1.0mol
F.Q3=2Q1
④在其他条件不变的情况下,将甲容器的体系体积压缩到1L,若在第8min达到新的平衡时A2的总转化率为75%,请在图1中画出第5min到新平衡时X的物质的量浓度的变化曲线.
(4)熔融碳酸盐燃料电池(MCFC)是一种高温燃料电池,被称为第二代燃料电池.目前已接近商业化,示范电站规模已达2MW,从技术发展趋势来看,是未来民用发电的理想选择方案之一.现以A2(g)、BC(g)为燃料,以一定比例Li2CO3和Na2CO3低熔混合物为电解质.写出碳酸盐燃料电池(MCFC)正极电极反应式 .
查看答案和解析>>
科目:高中化学 来源:2016-2017学年河南省高二上第一次月考化学卷(解析版) 题型:选择题
如图所示,下列叙述正确的是

A. Y为阴极,发生还原反应 B. X处有O2生成
C. Y与滤纸接触处有氧气生成 D. X与滤纸接触处变红
查看答案和解析>>
科目:高中化学 来源:2016-2017学年河南省高二上第一次月考化学卷(解析版) 题型:填空题
Ⅰ.按要求写出下列反应的热化学方程式:
(1)在25℃、101kPa下,1g甲醇液体燃烧生成C02和液态水时放热22.0kJ。则表示甲醇燃烧热的热化学方程式为__________________________。
(2)若适量的N2和02完全反应,每生成23g N02需要吸收16.0kJ热量,此反应的热化学方程式为___________________。
Ⅱ.对于下列三个反应,从正反开始进行达到平衡后,保持温度、体积 不变,按要求回答下列问题:
不变,按要求回答下列问题:
(1)PCl5(g) PCl3(g)+Cl2(g)
PCl3(g)+Cl2(g)
再充入PCl5(g),平衡向___________方向移动(填“正反应”或“逆反应”),达到平衡后,PCl5(g)的转化率___________(填“增大”、“减小”或“不变”,下同)。
(2)2HI(g) I2(g
I2(g )+H2(g)
)+H2(g)
再充入HI(g),平衡向___________方向移动,达到平衡后,HI的分解率___________。
(3)2NO2(g) N2O4(g)
N2O4(g)
再充入N2O4(g),平衡向___________方向移动,达到平衡后,NO2(g)的转化率___________。
查看答案和解析>>
科目:高中化学 来源:2016-2017学年河南省高二上第一次月考化学卷(解析版) 题型:选择题
在容积固定的4L密闭容器中进行可逆反应,X(g)+2Y(g) 2Z(g),并达到平衡。在此过程中,以Y的浓度改变表示的反应速率v(正)、v(逆)与时间t关系如图。则图中阴影部分的面积可表示 (
2Z(g),并达到平衡。在此过程中,以Y的浓度改变表示的反应速率v(正)、v(逆)与时间t关系如图。则图中阴影部分的面积可表示 (  )
)
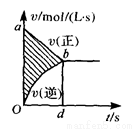
A .X的浓度的减少 B.Y物质的量的减少
.X的浓度的减少 B.Y物质的量的减少
C. Z的浓度的增加 D.X物质的量的减少
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| t/℃ | 5 | 15 | 25 | 35 | 50 |
| K | 1100 | 841 | 680 | 533 | 409 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 甲烷作为一种新能源在化学领域应用广泛,请回答下列问题:
甲烷作为一种新能源在化学领域应用广泛,请回答下列问题:| 时间/min | 5 | 10 | 15 | 20 | 25 | 30 |
| c(NH3)/(mol/L) | 0.08 | 0.14 | 0.18 | 0.20 | 0.20 | 0.20 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 高容量的储氢材料研究是推广应用氢氧燃料电池的关键问题之一 | |
| B. | 大力发展新型电动汽车,可以减少燃油汽车的尾气排放量 | |
| C. | 生活中常用的蚕丝、棉花、淀粉、油脂等都是由高分子组成的物质 | |
| D. | 塑料袋在全球“失宠”,有偿使用成为风尚,是因为塑料袋填埋占用土地且难以降解 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①③ | B. | ②③ | C. | ①② | D. | ③④ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com