
| A、A的最简式为CH2O |
| B、A可以发生氧化反应,不能发生还原反应 |
| C、A的同分异构体中可能含有二元醛 |
| D、若A为羟基酸时,能生成六元或八元环状内酯 |
| 40% |
| 12 |
| 6.67% |
| 1 |
| 53.33% |
| 16 |
| 100mL |
| 20mL |
| 0.90g |
| 0.01mol |
| 40% |
| 12 |
| 6.67% |
| 1 |
| 53.33% |
| 16 |
| 100mL |
| 20mL |
| 0.90g |
| 0.01mol |
| 90 |
| 30 |


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
| A、1L 1mol?L-1的NaClO溶液中含ClO-的数目为NA |
| B、78 g 苯含有碳碳双键的数目为3NA |
| C、12.0g熔融的NaHSO4 中含有的阳离子数为0.2NA |
| D、乙烯和乙醇共1 mol,完全燃烧消耗O2的分子数为3NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 放电 |
| 充电 |
| A、放电时,Li作负极 |
| B、电解质溶液为非水溶液体系 |
| C、充电时铁元素发生还原反应 |
| D、若用该电池电解饱和食盐水(电解池电极均为惰性电极)当电解池两极共有4480mL气体(标准状况)产生时,该电池消耗锂的质量为1.4 g |
查看答案和解析>>
科目:高中化学 来源: 题型:
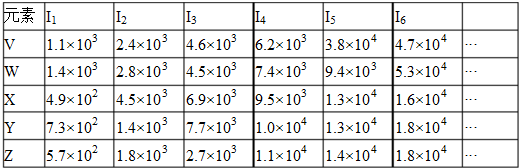
| A、原子半径X>Y>Z>V>W |
| B、最高价氧化物的水化物的碱性:Z>Y>W |
| C、W的单质只有还原性,没有氧化性 |
| D、以Y、Z作为电极,硫酸作为电解质溶液的原电池中,Y做负极 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、气体A为SO2和H2的混合物 |
| B、反应中共消耗Zn 65 g |
| C、气体A中SO2和H2的体积比为1:4 |
| D、反应中共转移3 mol电子 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com