
【题目】已知温度T时水的离子积常数为KW。该温度下,将浓度为a mol/L的一元酸HA与b mol/L的一元碱BOH等体积混合,可判定该溶液呈中性的依据是
A.a = b
B.混合溶液的pH = 7
C.混合溶液中,c(H+) = ![]() mol/L
mol/L
D.混合溶液中,c(H+) +c(B) = c(OH) + c(A)
科目:高中化学 来源: 题型:
【题目】下列叙述中正确的是
A. (CH3)2C=CHCH2CH3中所有碳原子共面
B. 苯不能使酸性高锰酸钾溶液褪色,证明苯分子中不存在单双键交替的结构
C. 聚乙烯能使溴水褪色
D. 甲醇、乙二醇(HOCH2CH2OH)互为同系物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)(现有下列5种有机物A.苯 B.乙烯 C.乙烷 D.乙醇 E.乙酸。(填代号)
①能与H2发生加成反应的有______________。
②能与Na反应的有______________________。
③ 能与NaOH溶液反应的有________________。
④常温下能与溴水反应的有________________。
(2)下列各组物质:
A、金刚石与石墨;B、淀粉与纤维素;C、氕与氘;D、甲烷与戊烷; E、![]() 与
与
F、 与
与
其中互为同位素 _____;(填编号.下同),互为同系物的是____,互为同分异构体的是___,属于同一物质的是______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】700℃时,向容积为2L的密闭容器中充入一定量的CO和H2O,发生反应:CO(g)+H2O(g)CO2(g)+H2(g)反应过程中测定的部分数据见下表(表中t2
反应时间/min | n(CO)/mol | n(H2O)/mol |
0 | 1.20 | 0.60 |
t1 | 0.80 | |
t2 | 0.20 |
下列说法正确的是
A. 反应在t1 min内的平均速率为v(H2)=0.40/t1molL1min1
B. 保持其他条件不变,起始时向容器中充入0.60 mol CO和0.10 mol H2O,达到平衡时n(CO2)=0.20 mol
C. 保持其他条件不变,向平衡体系中再通入0.20 mol H2O,与原平衡相比,达到新平衡时CO和H2O转化率增大
D. 温度升高至800℃,达到新平衡时n(CO2)=0.34 mol,则正反应为放热反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业制取ClO2:2NaClO3+SO2+H2SO4=2ClO2+2NaHSO4。下列说法正确的是( )
A.1mol氧化剂在反应中得到1mol电子 B.SO2在反应中被还原
C.H2SO4在反应中作氧化剂 D.NaClO3在反应中失去电子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在10 L密闭容器中,A、B、C三种气态物质构成了可逆反应体系;某温度时,A、B、C物质的量与时间的关系如图一,C的百分含量与温度的关系如图二.下列分析不正确的是 ( )
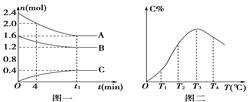
A. 该反应的平衡常数表达式为: 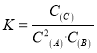
B. 0~4 min时,A的平均反应速率为0.01 mol/(L·min)
C. 由T1向T2变化时,v正>v逆
D. 平衡后升高温度,K值增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】天然食用香料X是芳香族化合物,可以从某些植物中提取。由X合成H的路线如下:

已知:①A的核磁共振氢谱有6个峰;②H为酯类物质,结构中除苯环外还含有一个六元环;③G的产量是衡量一个国家石油化工发展水平的标志。
请回答下列问题:
(1)A的结构简式为______,检验A中非含氧官能团所用的试剂为_______。
(2)②的反应类型为____________。反应③的化学方程式为_____________。
(3)F中所含官能团的名称为____________,其同分异构体中,遇FeCl3溶液发生显色反应,且能与碳酸氢钠溶液反应,其苯环上一氯代物只有一种,符合条件的同分异构体数目为________种,写出其中一种结构简式:____________。
(4)设计一条以G为起始原料合成乙二酸的路线______________,无机物任选,注明反应条件。示例如下: ![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学习小组为探究MnO2与FeCl3·6H2O的反应,设计了下列装置:

查阅文献有如下信息:①FeCl3 熔点282℃,沸点315℃, 2FeCl3 ![]() 2FeCl2+Cl2↑
2FeCl2+Cl2↑
②FeCl6·6H2O 熔点37℃,沸点285℃
实验过程记录:
操作步骤 | 现象 |
1.检查装置气密性,添加相应药品, 点燃酒精灯,开始给试管A加热 | |
2.打开a,关闭b、c, 用湿润的蓝色石蕊试纸贴近a口 | A中出现白雾,蓝色石蕊试纸变红 |
3.打开b,关闭a、c | A中逐渐产生黄色气体,试管及导管壁内附有黄色液滴,B中溶液变红 |
4.打开c,关闭a、b | C中溶液变棕黄色 |
5.停止加热 |
回答下列问题:
(1)A中的白雾是________________________。
(2)管壁内形成黄色液滴,可能的原因是______________________。
(3)B中溶液变红,请用离子方程式解释其原因_______________________。
(4)对C中溶液变黄色,小组展开进一步实验:

Ⅰ.C中变黄的原因是___________________________________________。
Ⅱ.C中发生反应的离子方程式是________________________________。
(5)对A中残留物进行分离,其中得到一种不溶于水的红棕色固体,写出A中生成该固体的化学方程式____________________________________。
(6)在A中MnO2发生的化学反应为__________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com