
| A. | 使用催化剂 | B. | 增加压强 | C. | 增大反应物浓度 | D. | 升高温度 |
分析 常见增大化学反应速率的措施有:增大浓度、压强,升高温度,使用催化剂等,增大单位体积的活化分子数目或增大活化分子百分数,从而增大反应速率,注意催化剂有正负之分,负催化剂降低反应速率,以此解答该题.
解答 解:A.催化剂能改变反应速率,可加快也可减慢,故A错误;
B.若反应中没有气体参加和生成,为溶液中的反应,则增加压强,反应速率不变,故B错误;
C.增大反应物浓度,单位体积的活化分子的数目增加,反应速率增大,故C正确;
D.因升高温度,活化分子百分数增大,反应速率加快,故D正确;
故选CD.
点评 本题考查影响化学反应速率的因素,注意物质的状态、反应的特点来分析影响反应速率的因素,题目难度不大.


 应用题天天练四川大学出版社系列答案
应用题天天练四川大学出版社系列答案科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 聚丙烯的链节:-CH2-CH2-CH2- | B. | 二氧化碳分子的比例模型: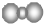 | ||
| C. | 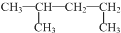 的名称:1,3-二甲基丁烷 的名称:1,3-二甲基丁烷 | D. | 氯离子的结构示意图: |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H、D、T互为同位素 | |
| B. | NaHCO3、HCOONa均含有离子键和共价键 | |
| C. | 常温常压下,22.4 L CCl4含有NA个CCl4分子 | |
| D. | 常温下,23 g NO2含有NA个氧原子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 若X为Fe,Y为Cu,铁为正极 | |
| B. | 若X为Fe,Y为Cu,电子由铜片流向铁片 | |
| C. | 若X为Fe,Y为C,碳棒上有红色固体析出 | |
| D. | 若X为Cu,Y为Zn,锌片发生还原反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 某一兴趣小组准备在实验室中制H2,装置如图所示.可是在实验室中发现酸液不足.为达到实验目的,则可以从长颈漏斗中加入下列试剂中的( )
某一兴趣小组准备在实验室中制H2,装置如图所示.可是在实验室中发现酸液不足.为达到实验目的,则可以从长颈漏斗中加入下列试剂中的( )| A. | NaNO3溶液 | B. | 四氯化碳 | C. | 苯 | D. | Na2CO3溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 可能有Cl-和SO42- | B. | 一定有Al3+ 和SO42- | ||
| C. | 可能有Al3+ 和Cl- | D. | 一定没有CO32- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com