
| A. | 含有非极性键的分子一定是非极性分子 | |
| B. | 非极性分子中一定含有非极性键 | |
| C. | 由极性键形成的双原子分子一定是极性分子 | |
| D. | 键的极性与分子的极性无关 |
分析 A.分子是否有极性取决于分子结构是否对称;
B.非极性分子中可能含有极性键,如甲烷分子,也可能含有非极性键,如氯气;
C.由极性键形成的双原子分子,分子中正负电荷中心不重合,从整个分子来看,电荷的分布是不均匀的,不对称的,所以是极性分子;
D.键的极性与形成共价键的元素有关,分子极性与分子中正负电荷中心是否重合,电荷的分布是否均匀有关.
解答 解:A.含有非极性键的分子可能是极性分子,关键看分子中正负电荷中心是否重合,从整个分子来看,电荷的分布是否均匀,如乙烷等有机物,碳碳键就是非极性键,乙烷是极性分子,故A错误;
B.形成非极性分子的化学键可能是极性键,有可能是非极性键,如甲烷分子是有极性键形成的非极性分子,故B错误;
C.由极性键形成的双原子分子,分子中正负电荷中心不重合,从整个分子来看,电荷的分布是不均匀的,不对称的,所以是极性分子,故C正确;
D.由于键的极性与形成共价键的元素有关,分子极性与分子中正负电荷中心是否重合,电荷的分布是否均匀有关,所以键的极性与分子的极性无关,故D正确;
故选CD.
点评 本题考查了分子极性与化学键的关系,同种非金属元素之间易形成非极性键,根据分子中正负电荷重心是否重合确定分子极性,题目难度不大.


科目:高中化学 来源: 题型:选择题
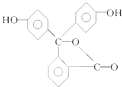
| A. | 酚酞与水可以形成氢键 | |
| B. | 酚酞的分子式为C20H14O4 | |
| C. | 酚酞结构中含有羟基(-OH),故酚酞属于醇 | |
| D. | 酚酞在一定条件下能够发生加成反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 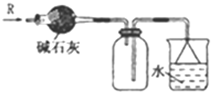 可用于SO2气体的干燥,收集并吸收多余SO2气体,防止SO2逸出污染空气并防止倒吸 可用于SO2气体的干燥,收集并吸收多余SO2气体,防止SO2逸出污染空气并防止倒吸 | |
| B. | 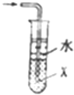 当X选用苯时可进行NH3和HCl的吸收,并防止倒吸 当X选用苯时可进行NH3和HCl的吸收,并防止倒吸 | |
| C. |  进行H2,NH3,CO2,Cl,HCl,NO2等气体收集,但不能用于NO气体收集 进行H2,NH3,CO2,Cl,HCl,NO2等气体收集,但不能用于NO气体收集 | |
| D. | 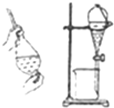 利用氯仿(CHCl3)密度大于乙醇,进行氯仿与乙醇混合物的分离 利用氯仿(CHCl3)密度大于乙醇,进行氯仿与乙醇混合物的分离 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 A、B、C是短周期非金属元素,核电荷数依次增大.A原子外围电子排布为ns2np2,C是地壳中含量最多的元素.D、E是第四周期元素,其中E元素的核电荷数为29.D原子核外未成对电子数在同周期中最多.请用对应的元素符号或化学式填空:
A、B、C是短周期非金属元素,核电荷数依次增大.A原子外围电子排布为ns2np2,C是地壳中含量最多的元素.D、E是第四周期元素,其中E元素的核电荷数为29.D原子核外未成对电子数在同周期中最多.请用对应的元素符号或化学式填空:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 配体为水分子,配原子为O,外界为Br- | |
| B. | 中心离子的配位数为6 | |
| C. | 中心离子Cr3+采取sp3杂化 | |
| D. | 中心离子的化合价为+2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 元素编号 元素性质 | ① | ② | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |
| 原子半径(10-10 m) | 0.74 | 1.60 | 1.52 | 1.10 | 0.99 | 1.86 | 0.75 | 0.82 | |
| 化合价 | 最高价 | +2 | +1 | +5 | +7 | +1 | +5 | +3 | |
| 负价 | -2 | -3 | -1 | -3 | |||||
| A. | 电负性的大小:⑥<②<④<⑤ | |
| B. | 单质熔点的高低:②<⑥ | |
| C. | 第一电离能的大小:③<⑧<⑦<① | |
| D. | 最高价氧化物对应水化物的酸性强弱:④<⑤<⑦ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用Pt电极电解少量的MgCl2溶液:2H2O+2Cl-$\frac{\underline{\;通电\;}}{\;}$H2↑+Cl2↑+2OH- | |
| B. | 向氢氧化亚铁中加入足量的稀硝酸:Fe(OH)2+2H+═Fe2++2H2O | |
| C. | 向NaAlO2溶液中通入过量CO2制Al(OH)3:AlO2-+CO2+2H2O═Al(OH)3↓+HCO3- | |
| D. | 用食醋除去水瓶中的水垢:CO32-+2CH3COOH═2CH3COO-+CO2↑+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 危险性 |  |
| 储运要求 | 远离金属粉末、氨、烃类、醇等物质;设置氯气检测仪 |
| 泄漏处理 | NaOH、NaHSO3溶液吸收 |
| 包装 | 钢瓶 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com