
 +CO2+H2O→
+CO2+H2O→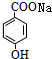 +NaHCO3.
+NaHCO3.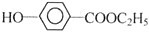
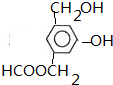 .
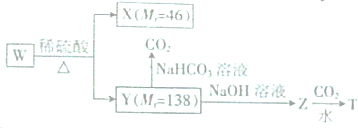
. 分析 Y遇氯化铁溶液发生显色反应,说明含有酚羟基,能与碳酸氢钠反应生成二氧化碳,则含有羧基,X为醇,根据其相对分子质量知,X结构简式为CH3CH2OH,Y中含有羧基和酚羟基,则C原子个数=$\frac{138-16×3}{12}$=7…6,W分子中,苯环上只有两种化学环境的氢原子,则W中两个取代基位于对位,则Y结构简式为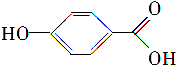 ,则W结构简式为
,则W结构简式为 ,Y和NaOH发生中和反应,Z结构简式为
,Y和NaOH发生中和反应,Z结构简式为 ,Z和二氧化碳、水反应生成T,T结构简式为
,Z和二氧化碳、水反应生成T,T结构简式为 ,据此分析解答.
,据此分析解答.
解答 解:Y遇氯化铁溶液发生显色反应,说明含有酚羟基,能与碳酸氢钠反应生成二氧化碳,则含有羧基,X为醇,根据其相对分子质量知,X结构简式为CH3CH2OH,Y中含有羧基和酚羟基,则C原子个数=$\frac{138-16×3}{12}$=7…6,W分子中,苯环上只有两种化学环境的氢原子,则W中两个取代基位于对位,则Y结构简式为 ,则W结构简式为
,则W结构简式为 ,Y和NaOH发生中和反应,Z结构简式为
,Y和NaOH发生中和反应,Z结构简式为 ,Z和二氧化碳、水反应生成T,T结构简式为
,Z和二氧化碳、水反应生成T,T结构简式为 ,
,
(1)X结构简式为CH3CH2OH,X的分子式能团名称是醇羟基或羟基,Y结构简式为 ,Y中官能团名称是羟基和羧基,
,Y中官能团名称是羟基和羧基,
故答案为:醇羟基或羟基;羟基和羧基;
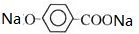
(2)Z生成T的化学方程式为 +CO2+H2O→
+CO2+H2O→ +NaHCO3,
+NaHCO3,
故答案为: +CO2+H2O→
+CO2+H2O→ +NaHCO3;
+NaHCO3;
(3)Y结构简式为 ,Y的系统命名是对羟基苯甲酸,W生成X和Y的反应类型是水解反应或取代反应,故答案为:对羟基苯甲酸;水解反应或取代反应;
,Y的系统命名是对羟基苯甲酸,W生成X和Y的反应类型是水解反应或取代反应,故答案为:对羟基苯甲酸;水解反应或取代反应;
(4)W的结构简式: ,故答案为:
,故答案为: ;
;
(5)若R能发生银镜反应,说明含有醛基,芳香族化合物R的分子式比W多2个氢原子,R苯环上有三个互为间位的取代基,等物质的量的R分别与足量钠、氢氧化钠、碳酸氢钠完全反应,消耗钠、氢氧化钠、碳酸氢钠的物质的量之比为3:2:1,说明R中含有1个羧基、1个酚羟基、1个醇羟基,结合R分子式知,R的结构简式为 ,
,
故答案为: .
.
点评 本题考查有机物推断,为高频考点,侧重考查学生分析判断能力,涉及有机物推断、官能团判断、方程式的书写等知识点,明确常见官能团及其性质关系是解本题关键,难点是(5)结构简式确定.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:解答题
| 编号 | 操作 | 现象 |
| Ⅰ | 先向2mL0.1mol•L-1FeCl2溶液中滴加KSCN溶液,再滴加新制氯水 | 滴加KSCN后溶液无明显变化, 加入氯水后溶液变成血红色. |
| Ⅱ | 先向2mL0.1mol•L-1FeCl3溶液中滴加KSCN溶液,再滴加0.1mol•L-1KI溶液 | 滴加KSCN溶液后,溶液变成血红色;滴加0.1mol•L-1KI溶液后,血红色无明显变化 |
| 编号 | 操作 | 现象 |
| Ⅲ | 向2mL0.1mol•L-1KI溶液中滴加1mL 0.1mol•L-1FeCl3溶液,再滴加KSCN溶液 | 滴加FeCl3溶液后,溶液变成黄色;滴加KSCN溶液后,溶液变成血红色 |
| 编号 | 操作 | 预期现象及结论 |
| Ⅳ | 向2mL0.1mol•L-1KI溶液中滴加1mL 0.1mol•L-1 FeCl3,溶液变黄色,取该溶液于两支试管中, 试管①中滴加滴加淀粉溶液(或CCl4), 试管②中滴加滴加铁氰化钾溶液. | 预期现象①溶液变蓝 (或溶液分层,下层溶液为紫红色),②出现特征蓝色沉淀. 结论Fe3+能与I-发生氧化还原反应,生成I2和Fe2+. |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
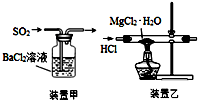
| A. | 焰色反应实验时,在蘸取待测液前,先用稀盐酸洗净铂丝并灼烧至无色 | |
| B. | 将2.5gCuSO4•5H2O溶于水配成100.0mL溶液,得到0.1mol•L-1硫酸铜溶液 | |
| C. | 用装置甲吸收SO2 | |
| D. | 用装置乙制取无水MgCl2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
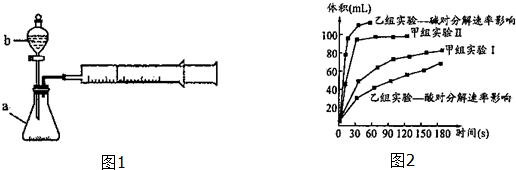
| 实验编号 | 实验目的 | t℃ | 催化剂 | 浓度 |
| 甲组实验Ⅰ | 做实验参照 | 25 | 3滴FeCl3溶液 | 10ml 2%H2O2 |
| 甲组实验Ⅱ | 探究浓度对速率的影响 | 25 | 10ml 5%H2O2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 第一次滴定 | 第二次滴定 | 第三次滴定 | |
| 待测溶液体积(mL) | 25.00 | 25.00 | 25.00 |
| 标准溶液体积(mL) | 9.99 | 10.01 | 10.00 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该电池充电时,锂极与外电源的负极相连 | |
| B. | 该电池放电时,Li+向负极移动 | |
| C. | 该电池充电时阴极的反应为LixV2O4-xe-=V2O4+xLi+ | |
| D. | 若放电时转移 0.2 mol 电子,则消耗锂 1.4x g |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com