
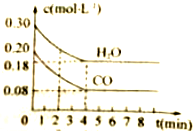 在一体积为10L的容器中,通入一定量的2molCO和2molH2O,在850℃时发生如下反应:CO(g)+H2O(g)?CO2(g)+H2(g)△H<0
在一体积为10L的容器中,通入一定量的2molCO和2molH2O,在850℃时发生如下反应:CO(g)+H2O(g)?CO2(g)+H2(g)△H<0| 时间(min) | CO | H2O | CO2 | H2 |
| 0 | 0.200 | 0.300 | 0 | 0 |
| 2 | 0.138 | 0.328 | 0.062 | 0.062 |
| 3 | C1 | CO2 | C3 | C3 |
| 4 | C1 | CO2 | C3 | C3 |
| 5 | 0.116 | 0.216 | 0.084 | |
| 6 | 0.096 | 0.266 | 0.104 |
 CO2(g)十H2 (g)的平衡常数k=
CO2(g)十H2 (g)的平衡常数k=| c(CO2)?c(H2) |
| c(CO)?c(H2O) |
| 0.12mol/L |
| 2.0mol/L |
| c(CO2)?c(H2) |
| c(CO)?c(H2O) |
| 0.12×0.12 |
| 0.18×0.08 |
| 0.8×0.8 |
| 0.2×1.2 |
| 8 |
| 3 |


科目:高中化学 来源: 题型:
 具有复合官能团的复杂有机物:官能团具有各自的独立性,在不同条件下所发生的化学性质可分别从各官能团讨论.如:具有三个官能团分别是(填名称):
具有复合官能团的复杂有机物:官能团具有各自的独立性,在不同条件下所发生的化学性质可分别从各官能团讨论.如:具有三个官能团分别是(填名称):查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、K2MnO4、KMnO4、MnO2三者中Mn元素的化合价逐渐升高 |
| B、NaCl、Na2CO3、NaOH三者饱和溶液的pH逐渐变大 |
| C、NH4NO3、NaCl、CaO三者溶于水后,所得溶液的温度逐渐降低 |
| D、金、银、铜金属活动性顺序逐渐减弱 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、甲容器中的反应先达到化学平衡状态 |
| B、在甲容器中再充入2 mol A和2 mol B,平衡向正反应方向移动,此时平衡常数增大 |
| C、两容器达平衡后升高相同的温度,达到新的平衡.甲、乙容器中平衡混合物中的各组分体积分数不同 |
| D、两容器中的反应均达平衡时,平衡混合物中各组分的体积分数相同,混合气体的平均相对分子质量也相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 研究氮的固定具有重要意义.
研究氮的固定具有重要意义.| 序号 | 第一组 | 第二组 | 第三组 | 第四组 |
| t/℃ | 30 | 40 | 50 | 80 |
| NH3生成量/(10-6mol) | 4.8 | 5.9 | 6.0 | 2.0 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 放电 |
| 充电 |
| A、放电时的负极反应为:PbO2+4 H+十2e-=Pb2++2H2O |
| B、充电时,当阳极质量增加23.9 g时溶液中有0.2mo1电子通过 |
| C、放电时,正极区pH增大 |
| D、充电时,Pb电极与电源的正极相连 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com