某小型氯碱厂采用电解氯化钠溶液的方法生产氯气、氢气和氢氧化钠.该工厂平均每天生产80%的氢氧化钠15t.回答:
(1)写出电解氯化钠溶液的化学反应方程式.
(2)该工厂生产一个月(按30天计算)至少需要多少吨的氯化钠?
(3)工厂通常进行联合生产,假设把一个月生成的氯气、氢气全部转化为盐酸,可得到质量分数为36.5%的盐酸多少吨?
【答案】
分析:(1)电解氯化钠溶液反应生成NaOH、氢气、氯气;
(2)根据化学反应方程式,将氢氧化钠的质量代入计算来求需要的氯化钠;
(3)先利用化学反应方程式,将氢氧化钠的质量代入计算氯气的质量,再计算其标准状况下的体积.
解答:解:(1)电解氯化钠溶液反应生成NaOH、氢气、氯气,化学反应为2NaCl+2H
2O

2NaOH+H
2↑+Cl
2↑,
答:电解反应为2NaCl+2H
2O

2NaOH+H
2↑+Cl
2↑;
(2)设该工厂每天至少需要氯化钠的质量为x,可生产氯气的质量为y,则
2NaCl+2H
2O

2NaOH+H
2↑+Cl
2↑
117 80 71
x 80%×15t y
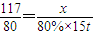
,解得x=17.55t,
该工厂平均每天至少需要17.55吨的氯化钠,
则每个月需要17.55t×30=526.5t,
答:该工厂每月至少需要526.5吨的氯化钠;
(3)
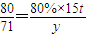
,解得y=10.65t,
氯气的物质的量为
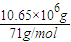
=0.15×10
6mol,
氯气、氢气全部转化为盐酸,可得到质量分数为36.5%的盐酸为
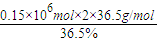
×30=900t,
答:得到质量分数为36.5%的盐酸900t.
点评:本题考查学生利用电解的化学反应方程式来计算,题目难度不大,注意将NaOH的质量代入化学反应方程式计算即可.

 2NaOH+H2↑+Cl2↑,
2NaOH+H2↑+Cl2↑, 2NaOH+H2↑+Cl2↑;
2NaOH+H2↑+Cl2↑; 2NaOH+H2↑+Cl2↑
2NaOH+H2↑+Cl2↑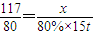 ,解得x=17.55t,
,解得x=17.55t,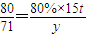 ,解得y=10.65t,
,解得y=10.65t,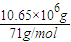 =0.15×106mol,
=0.15×106mol,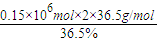 ×30=900t,
×30=900t,

 同步奥数系列答案
同步奥数系列答案