
| A. | 电能是二次能源 | B. | 水力是一次能源 | ||
| C. | 天然气是一次能源 | D. | 蒸汽是一次能源 |
 一诺书业暑假作业快乐假期云南美术出版社系列答案
一诺书业暑假作业快乐假期云南美术出版社系列答案科目:高中化学 来源: 题型:填空题
 有的油田开采的石油中溶有一种碳氢化合物--金刚烷,它的分子立体结构如图所示:
有的油田开采的石油中溶有一种碳氢化合物--金刚烷,它的分子立体结构如图所示:查看答案和解析>>
科目:高中化学 来源: 题型:填空题
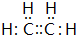 ;
;
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 硅晶体是一种重要的半导体材料 | |
| B. | 石墨可用做绝缘材料 | |
| C. | 漂白粉的有效成分是次氯酸钙 | |
| D. | 常温下,运输浓硫酸、浓硝酸时可用铝制或铁制槽车 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 使用催化剂是为了加快反应速率,提高生产效率 | |
| B. | 在上述条件下,SO2不可能100%地转化为SO3 | |
| C. | 无论怎样控制反应条件,2 mol SO2与1 mol O2 反应时都不会生成2 mol SO3 | |
| D. | 达到平衡时,SO2的浓度与SO3的浓度相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 取两份10mL 1mol•L-1稀盐酸,向其中一份中加入过量的锌粒,得到气体的体积随时间变化如b所示,向另一份中加入过量的锌粒同时加入另一种物质,得到气体的体积如a所示,则另一种物质是( )
取两份10mL 1mol•L-1稀盐酸,向其中一份中加入过量的锌粒,得到气体的体积随时间变化如b所示,向另一份中加入过量的锌粒同时加入另一种物质,得到气体的体积如a所示,则另一种物质是( )| A. | 铝粉 | B. | 3 mol•L-1稀硫酸 | C. | 铁粉 | D. | 氢氧化钠固体 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
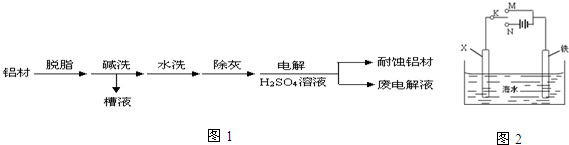
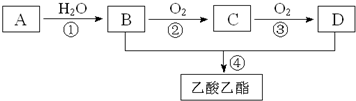
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 BaS是一种白色晶体,微溶于水,可用于制备立德粉、Na2S等.工业上可用H2与重晶石(BaS04)在高温下反应制备BaS,热化学方程式为BaS04(s)+4H2(g)?BaS(s)+4H20(g)△H=+xkJ•mol-1(x>0).回答下列问题:
BaS是一种白色晶体,微溶于水,可用于制备立德粉、Na2S等.工业上可用H2与重晶石(BaS04)在高温下反应制备BaS,热化学方程式为BaS04(s)+4H2(g)?BaS(s)+4H20(g)△H=+xkJ•mol-1(x>0).回答下列问题:| 时间/min | 0 | t | 2t | 3t | 4t |
| n(H2)/mol | 2.00 | 1.50 | n | 0.90 | 0.80 |
| 试验编号 | T/℃ | c起始(H2)/mol•L-1 | 重晶石的比表面积/m2•g-1 |
| Ⅰ | 850 | c1 | 3.4 |
| Ⅱ | T1 | 0.80 | 7.6 |
| Ⅲ | 900 | 0.80 | 7.6 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com