
【题目】2008年北京残奥会吉祥物是以牛为形象设计的“福牛乐乐”(Funiulele)。有一种有机物的键线式也酷似牛形(下图所示),故称为牛式二烯炔醇。下列有关说法正确的是( )

A.牛式二烯炔醇含有4种官能团
B.牛式二烯炔醇不能使酸性KMnO4溶液褪色
C.1 mol牛式二烯炔醇最多可跟4mol Br2发生加成反应
D.该有机物的化学式为C29H44O
科目:高中化学 来源: 题型:
【题目】某研究性学习小组为了制取、收集纯净干燥的氯气并探究氯气的性质,他们设计了如图所示的实验装置:

请回答下列问题:
(1)整套实验装置的连接顺序是f接( )( )接( )( )接( )(填各接口处的字母代号)。
(2)E装置中制取氯气的离子方程式是 。
(3)A装置中试剂X是 。
(4)C装置中的现象是 产生此现象的原因是 (用离子方程式和必要的文字解释)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有前四周期六种元素X、Y、Z、E、F、G,它们的原子序数依次增大,除G外,其他五种元素都是短周期元素。X、Y、E三种元素组成的化合物是实验室常用燃料,也是一种家庭常见饮品的主要成分。取F的化合物做焰色反应实验,其焰色呈黄色,G的单质是生活中常见的一种金属,GE是黑色固体。G2E是红色固体。请回答下列问题:
(1)写出基态G原子电子排布式: ;Y、Z、E、F、G的第一电离能由小到大的顺序为 (用元素符号表示)。
(2)X、Y、Z形成3原子分子M,每个原子价层电子均达到稳定结构。M分子的结构式为 。1molM含![]() 键数目为 。
键数目为 。

(3)根据价层电子对互斥理论(VESPR)推测:ZE2—的立体构型为 ,YE32—的中心原子杂化类型为 。
(4)Y、E、Z分别与X形成的简单化合物沸点由高到底的顺序为 (用化学式表示) 。
(5)G晶胞结构如图所示。已知立方体的棱长为apm,G 晶体密度为bg·cm-3,则阿伏加德罗常数NA= (用含a、b的代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由A、B、C、D四种金属按下表中装置进行实验。
装置 |
|
|
|
现象 | 二价金属A 不断溶解 | C的质 量增加 | A上有气 体产生 |
根据实验现象回答下列问题:
(1)装置甲中负极的电极反应式是____________________________________。
(2)装置乙中正极的电极反应式是_____________________________________,溶液中Cu2+向______极移动(填“B”或“C”)。
(3)当装置丙中产生3.36L(标准状况)气体时,电路中转移的电子数目为____________。
(4)四种金属活动性由强到弱的顺序是__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】运用化学反应原理研究碳、氮的单质及其化合物的反应对缓解环境污染、能源危机具有重要意义。
(1)甲醇作为一种重要的化工原料,既可以作为燃料,还可用于合成其它化工原料。在一定条件下可利用甲醇羰基化法制取甲酸甲酯,其反应原理可表示为:CH3OH(g)+CO(g)![]() HCOOCH3(g) △H=-29.1kJ/mol。向体积为2 L的密闭容器中充入2mol CH3OH(g)和2molCO,测得容器内的压强(p:kPa)随时间(min)的变化关系如下图中Ⅰ、Ⅱ、Ⅲ曲线所示:
HCOOCH3(g) △H=-29.1kJ/mol。向体积为2 L的密闭容器中充入2mol CH3OH(g)和2molCO,测得容器内的压强(p:kPa)随时间(min)的变化关系如下图中Ⅰ、Ⅱ、Ⅲ曲线所示:

①Ⅱ和Ⅰ相比,改变的反应条件是 。
②反应Ⅰ在5 min时达到平衡,在此条件下从反应开始到达到平衡时v(HCOOCH3)= 。
③反应Ⅱ在2 min时达到平衡,平衡常数K(Ⅱ)= 。在体积和温度不变的条件下,在上述反应达到平衡Ⅱ时,再往容器中加入1 mol CO和2mol HCOOCH3后v(正)______ v(逆)(填“>”“<”“=”),原因是________________。
④比较反应Ⅰ的温度(T1)和反应Ⅲ的温度(T3)的高低:T1 T3(填“>”“<”“=”),判断的理由是_____________________________。
(2)超音速飞机在平流层飞行时,尾气中的NO会破坏臭氧层。科学家正在研究利用催化技术将尾气中的NO和CO转变成CO2和N2。某研究小组在实验室用某新型催化剂对CO、NO催化转化进行研究,测得NO转化为N2的转化率随温度、CO混存量的变化情况如下图所示,利用以下反应填空:NO+CO![]() N2+CO2(有CO) 2NO
N2+CO2(有CO) 2NO![]() N2+O2(无CO)
N2+O2(无CO)

①若不使用CO,温度超过775 ℃,发现NO的分解率降低,其可能的原因为 ;
②在n(NO)/n(CO)=1的条件下,应控制最佳温度在 左右。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铬是一种具有战略意义的金属,它具有多种价态,单质铬熔点为1857 ℃。
(1)工业上以铬铁矿[主要成分是Fe(CrO2)2]为原料冶炼铬的流程如图所示:
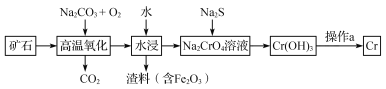
①Fe(CrO2)2中各元素化合价均为整数,则铬为_______价。
②高温氧化时反应的化学方程式为___________________________________。
③操作a由两种均发生了化学反应的过程构成的,其内容分别是_______________、铝热反应。
(2)Cr(OH)3是两性氢氧化物,请写出其分别与NaOH、稀硫酸反应时生成的两种盐的化学式____________________________。
(3)铬元素能形成含氧酸及含氧酸盐,若测得初始浓度为1 mol/L的铬酸 (H2CrO4) 溶液中各种含铬元素的微粒浓度分别为:c(![]() )=0.0005 mol·L1、c(
)=0.0005 mol·L1、c(![]() )=0.1035 mol·L1、c(
)=0.1035 mol·L1、c(![]() )=a mol·L1、则a=______,KHCrO4溶液中c(OH)___c(H+)(填“>”、“<”或“=”)。
)=a mol·L1、则a=______,KHCrO4溶液中c(OH)___c(H+)(填“>”、“<”或“=”)。
(4)水中的铬元素对水质及环境均有严重的损害作用,必须进行无害化处理。
①处理含有![]() 的污水方法通常为:用铁作电极电解污水,
的污水方法通常为:用铁作电极电解污水,![]() 被阳极区生成的离子还原成为Cr3+,生成的Cr3+与阴极区生成的OH结合生成Cr(OH)3沉淀除去。则阴极上的电极反应式为_________________________,若要处理含10 mol
被阳极区生成的离子还原成为Cr3+,生成的Cr3+与阴极区生成的OH结合生成Cr(OH)3沉淀除去。则阴极上的电极反应式为_________________________,若要处理含10 mol ![]() 的污水,则至少需要消耗的铁为_______g。
的污水,则至少需要消耗的铁为_______g。
②转化为重要产品磁性铁铬氧体(CrxFeyOz):先向含![]() 的污水中加入适量的硫酸及硫酸亚铁,待充分反应后再通入适量空气(氧化部分Fe2+)并加入NaOH,就可以使铬、铁元素全部转化为磁性铁铬氧体。写出
的污水中加入适量的硫酸及硫酸亚铁,待充分反应后再通入适量空气(氧化部分Fe2+)并加入NaOH,就可以使铬、铁元素全部转化为磁性铁铬氧体。写出![]() 在酸性条件下被Fe2+还原为Cr3+ 的离子方程式:____________________________________,若处理含1 mol
在酸性条件下被Fe2+还原为Cr3+ 的离子方程式:____________________________________,若处理含1 mol![]() (不考虑其它含铬微粒) 的污水时恰好消耗10 mol FeSO4,则当铁铬氧体中n(Fe2+)∶n(Fe3+)=3∶2时,铁铬氧体的化学式为__________。
(不考虑其它含铬微粒) 的污水时恰好消耗10 mol FeSO4,则当铁铬氧体中n(Fe2+)∶n(Fe3+)=3∶2时,铁铬氧体的化学式为__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物的结构可用“键线式”简化表示。CH3-CH=CH-CH3可简写为![]() 。有机物X的键线式为
。有机物X的键线式为
(1)有机物Y是X的同分异构体,且属于芳香烃, Y在一定条件能发生聚合反应,写出其化学方程式____________________________________________ 。
(2)X与足量的H2在一定条件下反应可生成环状的饱和烃Z,Z的一氯代物有___________ 种。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】目前,回收溴单质的方法主要有水蒸气蒸馏法和萃取法等。某兴趣小组通过查阅相关资料拟采用如下方案从富马酸废液(含溴0.27%)中回收易挥发的Br2:

(1)操作X所需要的主要玻璃仪器为 ;该仪器使用前须检漏,检验方法为 。
(2)反萃取时加入20%的NaOH溶液,其离子方程式为 。
(3)反萃取所得水相酸化时,需缓慢加入浓硫酸,并采用冰水浴冷却的原因是 。
(4)溴的传统生产流程为先采用氯气氧化,再用空气水蒸气将Br2吹出;与传统工艺相比,萃取法的优点是 。
(5)我国废水三级排放标准规定:废水中苯酚的含量不得超过1.00mg·L―1,实验室可用一定浓度的溴水测定某废水中苯酚的含量,其原理如下:

①请完成相应的实验步骤:
步骤1:准确量取25.00mL待测废水于250mL锥形瓶中。
步骤2:将4.5mL 0.02mol·L―1溴水迅速加入到锥形瓶中,塞紧瓶塞,振荡。
步骤3:打开瓶塞,向锥形瓶中加入过量的0.1mol·L―1 KI溶液,振荡。
步骤4: ,再用0.01mol·L―1 Na2S2O3标准溶液滴定至终点,消耗 Na2S2O3溶液15mL(反应原理:I2+2Na2S2O3=2NaI+Na2S4O6)。
步骤5:将实验步骤1~4重复2次。
②该废水中苯酚的含量为 mg·L―1。
③步骤3若持续时间较长,则测得的废水中苯酚的含量 (填“偏高”、“偏低”或“无影响”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是合成有机高分子材料W的流程图:

已知: 
回答下列问题:(1)B的结构简式:____ ____
(2)E中所含官能团的结构简式:
(3)B→C反应类型为_ _____ __
(4)写出下列反应的化学方程式:
D+E→W:___________ __
C与银氨溶液反应:___________ ___
(5)满足以下条件的E的同分异构体有 种
① 可发生银镜反应 ② 可与NaHCO3溶液生成CO2 ③能与FeCl3溶液反应显紫色
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com