
【题目】氨氮废水是生活中常见污染物之一,可用电解法加以去除。实验室用石墨电极电解一定浓度的(NH4)2SO4与NaCl混合溶液来模拟该过程。
(1)电解处理氨氮废水电解过程中,溶液初始Cl-浓度和pH对氨氮去除速率与能耗(处理一定量氨氮消耗的电能)的影响关系如图1和图2所示:
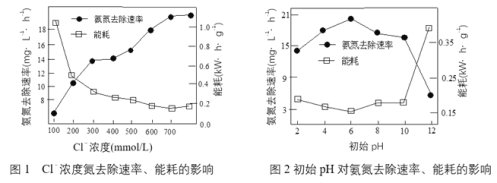
①根据图中数据,处理废水合适的条件是_______________。
②实验中发现阳极会持续产生细小气泡,气泡上浮过程中又迅速消失。结合图1,用电极反应式和离子方程式解释Cl-去除氨氮的原因_______________。
③图1中当Cl-浓度较低时、图2中当初始pH达到12时,均出现氨氮去除速率低而能耗高的现象,共同原因是_______________。
(2)氨的定量测定使用下图装置检测废水中的氨氮总量是否合格。
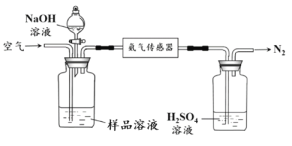
①利用平衡原理分析含氨氮水样中加入NaOH溶液的作用:_______________。
②若利用氨气传感器将1 L水样中的氨氮完全转化为N2时,转移电子的物质的量为6×10-4 mol,则样品混合液中氨氮(以氨气计)含量为_______________mg·L-1。
【答案】Cl-浓度为700 mmol/L、pH为6 2Cl--2e- = Cl2↑、3Cl2+2NH4+ =N2 +6Cl-+8H+ 阳极可能OH-放电,产生大量氧气,消耗电能 c(OH-)增大,使NH4+ + OH- NH3·H2O NH3 + H2O平衡正向移动,利于生成氨气,被空气吹出 3.4
【解析】
(1))①根据图1和图2分析Cl-浓度和溶液的pH的合适条件;②阳极失去电子发生氧化反应,阳极上氯离子放电生成氯气,氯气又被铵根离子还原,据此分析解答;③阳极可能是OH-放电,产生大量氧气,消耗电能来分析;
(2)①氢氧根离子浓度的变化对NH4++OH-NH3H2ONH3+H2O平衡的影响分析解答;②依据氮元素守恒和电子转移守恒计算水样中氨氮(以氨气计)含量。
(1)①根据图1可知,Cl-浓度为700 mmol/L,废水中氨氮去除速率较高;根据图2可知,pH为6时,废水中氨氮去除速率最高;因此处理废水合适的条件是,故答案为:Cl-浓度为700 mmol/L、pH为6;
②阳极失去电子发生氧化反应,故电极反应方程式为2Cl--2e-=Cl2↑,实验中发现阳极会持续产生细小气泡,生成的氯气能够将铵根离子氧化,达到除去氨氮的目的,3Cl2+2NH4+ =N2 +6Cl-+8H+,气体减少,因此看到气泡上浮过程中又迅速消失,故答案为:2Cl--2e-=Cl2↑、3Cl2+2NH4+ =N2 +6Cl-+8H+;
③图1中当Cl-浓度较低时、图2中当初始pH达到12时,均出现氨氮去除速率低而能耗高的现象,原因可能是阳极发生的反应为4OH--4e-=O2↑+H2O,则阳极可能OH-放电,产生大量氧气,消耗电能,故答案为:阳极可能OH-放电,产生大量氧气,消耗电能;
(2)①含氨氮水样中加入NaOH溶液,使得溶液中c(OH-)增大,使NH4++OH-NH3H2ONH3+H2O平衡正向移动,利于生成氨气,被空气吹出,故答案为:c(OH-)增大,使NH4++OH-NH3H2ONH3+H2O平衡正向移动,利于生成氨气,被空气吹出;
②将1L水样中的氨氮完全转化为N2时,转移电子的物质的量为6×10-4mol,依据氮元素守恒2NH3~N2~6e-,有![]() =
=![]() ,解得:n(NH3)=2×10-4mol/L,水样中氨氮(以氨气计)含量=2×10-4mol/L×17g/mol=3.4×10-3g/L=3.4mg/L,故答案为:3.4。
,解得:n(NH3)=2×10-4mol/L,水样中氨氮(以氨气计)含量=2×10-4mol/L×17g/mol=3.4×10-3g/L=3.4mg/L,故答案为:3.4。


科目:高中化学 来源: 题型:
【题目】已知高锰酸钾与重铬酸钾(K2Cr2O7)都是化学中常用的强氧化剂,高锰酸钾溶液呈紫红色而重铬酸钾溶液中存在如下平衡:2CrO42-(黄色)+2H+![]() Cr2O72-(橙色)+H2O,若要使溶液的橙色加深,下列可采用的方法是( )
Cr2O72-(橙色)+H2O,若要使溶液的橙色加深,下列可采用的方法是( )
A.加入适量小苏打B.加入适量稀硝酸
C.加入适量烧碱固体D.加水稀释
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA为阿伏加德罗常数的值,下列说法正确的是
A.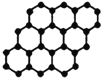 24g石墨烯中含有C-C键的个数为3NA
24g石墨烯中含有C-C键的个数为3NA
B.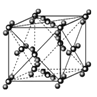 88g干冰中含有NA个晶胞结构单元
88g干冰中含有NA个晶胞结构单元
C.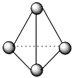 62gP4含有P-P键的个数为6NA
62gP4含有P-P键的个数为6NA
D.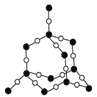 60gSiO2中含有Si-O键的个数为2NA
60gSiO2中含有Si-O键的个数为2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】北京大学和中国科学院的化学工作者合作,已成功研制出碱金属与C60形成的石墨夹层离子化合物。将石墨置于熔融的钾或气态的钾中,石墨吸收钾而形成称为钾石墨的物质,其组成可以是C8K、C12K、C24K、C36K、C48K、C60K等等。在钾石墨中,钾原子把价电子交给石墨层,但在遇到与金属钾易反应的其他物质时还会收回。下列分析中正确的是( )

A. 题干中所举出的6种钾石墨,属于同素异形体
B. 若某钾石墨的原于分布如图一所示,则它所表示的是C24K
C. 若某钾石墨的原子分布如图二所示,则它所表示的是C12K
D. 另有一种灰色的钾石墨C32K,其中K的分布也类似图中的中心六边形,则最近两个K原子之间的距离为石墨键长的4![]() 倍
倍
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究表明:H2O2具有立体结构,两个氢原子像在一本半展开的书的两页纸上,两页纸面的夹角为94°,氧原子在书的夹缝上,O—H键与O—O键之间的夹角为97°。下列说法不正确的是( )
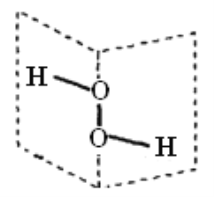
A. H2O2分子中既含极性键,又含非极性键
B. H2O2为极性分子
C. H2O2分子中的两个O原子均是sp3杂化
D. H2O2分子中既有σ键,又有π键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是( )
A.NH3中氮原子的杂化方式为sp3杂化
B.[Cu(NH3)4]2+中,NH3是配体
C.NH4+、PH4+、CH4、BH4-互为等电子体
D.NH3的沸点比PH3的沸点低
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碳、氮、氧、氟、硫是中学常见的非金属元素,铁离子可与由这几种元素组成的SCN-、CN-、F-等形成很多配合物。
(1)基态Fe原子中,电子占据的最高电子层符号为__,该电子层具有的原子轨道数为__。
(2)已知(CN)2是直线形分子,并有对称性,则(CN)2中π键和σ键的个数比为__;在配合物[Fe(SCN)]2+中,提供空轨道接受孤对电子的微粒是__。
(3)配合物K4[Fe(CN)6]中不存在的作用力是__(填序号)。
A.极性键 B.离子键 C.非极性键 D.配位键
(4)写出一种与SCN-互为等电子体的分子__(用化学式表示),该分子的空间构型为__。
(5)已知乙烯酮(CH2=C=O)是一种重要的有机中间体,可由CH3COOH在(C2H5O)3P=O存在下加热脱H2O得到。乙烯酮分子中碳原子的杂化轨道类型是__。1mol(C2H5O)3P=O分子中含有的σ键的物质的量为__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】β-氮化碳的硬度超过金刚石晶体,成为首屈一指的超硬新材料,已知该氮化碳的二维晶体结构如图所示。下列说法不正确的是( )
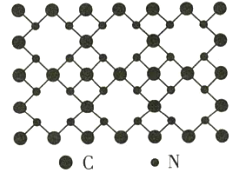
A.该晶体中的碳、氮原子都满足8电子稳定结构
B.该晶体中碳显+4价,氮显-3价
C.该晶体中每个碳原子与四个氮原子相连,每个氮原子与三个碳原子相连
D.该晶体的分子式为C3N4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某科学研究小组制备硝基苯的实验装置如图所示,相关数据见下表。已知该实验中存在的主要副反应是:在温度稍高的情况下会生成间二硝基苯。
物质 | 熔点/℃ | 沸点/℃ | 密度/( | 溶解性 |
苯 | 5.5 | 80 | 0.88 | 微溶于水 |
硝基苯 | 5.7 | 210.9 | 1.205 | 难溶于水 |
间二硝基苯 | 89 | 301 | 1.57 | 微溶于水 |
浓硝酸 | 83 | 1.4 | 易溶于水 | |
浓硫酸 | 338 | 1.84 | 易溶于水 |
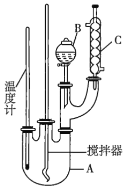
实验步骤如下:
取![]() 浓硫酸与足量浓硝酸配制成混合酸,将混合酸小心加入
浓硫酸与足量浓硝酸配制成混合酸,将混合酸小心加入![]() 中。取
中。取![]() 苯加入
苯加入![]() 中。在室温下,向苯中逐滴加入混合酸,边滴加边搅拌,混合均匀加热,使其在/span>50~60℃下发生反应,直至反应结束。将反应液冷却至室温后倒入分液漏斗中,依次用少量水、
中。在室温下,向苯中逐滴加入混合酸,边滴加边搅拌,混合均匀加热,使其在/span>50~60℃下发生反应,直至反应结束。将反应液冷却至室温后倒入分液漏斗中,依次用少量水、![]() 溶液和水洗涤。在分出的产物中加入无水
溶液和水洗涤。在分出的产物中加入无水![]() 颗粒,静置片刻,过滤,对滤液进行蒸馏纯化,收集205~210℃的馏分,得到纯硝基苯
颗粒,静置片刻,过滤,对滤液进行蒸馏纯化,收集205~210℃的馏分,得到纯硝基苯![]() 。
。
回答下列问题:
(1)图中装置![]() 的作用是______。
的作用是______。
(2)制备硝基苯的化学反应方程式为___________。
(3)配制混合酸时,能否将浓硝酸加入到浓硫酸中?_____(填“能”或“不能”),说明理由:_______。
(4)为了使反应在50-60 ℃下进行,常采用的加热方法是_____。反应结束并冷却至室温后![]() 中液体为粗硝基苯,粗硝基苯呈黄色的原因是_________。
中液体为粗硝基苯,粗硝基苯呈黄色的原因是_________。
(5)在洗涤操作中,第二次水洗的目的是____。
(6)本实验所得到的硝基苯的产率是_______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com