
| A. | W03中W的化合价是+3价 | |
| B. | W03属于非金属氧化物 | |
| C. | 当消耗22.4L氢气时可以得到$\frac{1}{3}$ mol W | |
| D. | 当有1.8g水生成时,转移0.2 mol电子 |
分析 反应W03+3H2$\frac{\underline{\;高温\;}}{\;}$W+3H20中,W元素化合价由+6价降低到0价,被还原,W03为氧化剂,H元素化合价由0价升高到+1价,被氧化,H2为还原剂,结合化合价的变化以及方程式计算电子的转移,以此解答该题.
解答 解:A.W03中W的化合价是+6价、O为-2价,故A错误;
B.W为金属,W03为金属氧化物,故B错误;
C.氢气存在的条件未知,不一定为标准状况下,不能计算氢气的物质的量,故C错误;
D.n(H20)=$\frac{1.8g}{18g/mol}$=0.1mol,由方程式可知有1mol氢气参加反应,则有0.2mol电子转移,故D正确.
故选D.
点评 本题考查氧化还原反应,为高频考点,侧重于学生的分析、计算能力的考查,注意把握元素化合价的变化,为解答该类题目的关键,难度不大.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
| A. | Fe(OH)3胶体与硅酸胶体(硅酸胶体微粒带负电荷)混合将产生聚沉现象 | |
| B. | Fe(OH)3胶体粒子在电场影响下将向正极运动 | |
| C. | Fe(OH)3胶体粒子不停地做布朗运动 | |
| D. | 光线通过Fe(OH)3胶体时会产生丁达尔效应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NO2和H2O反应毎生成2mol HNO3时转移的电子数目为2NA | |
| B. | 1mol苯分子中含有3NA个碳碳单键 | |
| C. | 24g NaH中阴离子所含电子总数为NA | |
| D. | 在0.1mol/LK2CO3溶液中,阴离子数目大于0.1NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 相同浓度时,溶液的导电能力的强弱 | |
| B. | 在水溶液里电解质是否全部电离为离子 | |
| C. | 是离子化合物还是共价化合物 | |
| D. | 强电解质易溶于水,弱电解质难溶于水 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 淀粉和纤维素的化学式都是(C6H10O5)n,故互为同分异构体 | |
| B. | 不含杂质的天然油脂属于高分子化合物,有固定的熔、沸点 | |
| C. | 蔗糖、植物油、天然蛋白质完全燃烧后的最终产物均为C02和H20 | |
| D. | 纤维素乙酸酯、油脂、蛋白质和麦芽糖在一定条件下都能水解 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
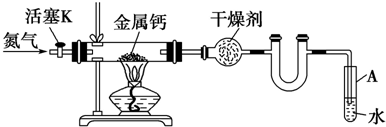
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 目前工业上有一种方法是用CO2生产燃料甲醇.一定条件下发生反应:CO2+3H2?CH3OH+H2O,该反应的能量变化如图所示:
目前工业上有一种方法是用CO2生产燃料甲醇.一定条件下发生反应:CO2+3H2?CH3OH+H2O,该反应的能量变化如图所示:| t/min | 0 | 2 | 5 | 10 | 15 |
| n(CO2)/mol | 1 | 0.75 | 0.5 | 0.25 | 0.25 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题

查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com