
| 温度/℃ | 200 | 300 | 400 |
| K | 1.0 | 0.86 | 0.5 |
分析 (1)已知:①4NH3(g)+3O2(g)═2N2(g)+6H2O(g);△H=-1266.5kJ/mol;
②N2(g)+O2(g)═2NO(g);△H=+180.5kJ/mol,利用盖斯定律可求知反应热;根据平衡常数等于生成物的浓度幂之积除以反应物的浓度幂之积计算;
(2)氨气可以构成燃料电池,其电池反应原理为4NH3+3O2=2N2+6H2O.氨分子中氮元素的化合价升高,发生氧化反应,应通入燃料电池的负极,电解质溶液为KOH溶液,负极的电极反应式为2NH3+6OH--6e-═N2+6H2O;
(3)①温度升高,向吸热方向进行,由图象得,平衡常数减小,故逆向进行,故逆反应吸热,则正反应放热,△H<0;
②为了增大平衡时H2的转化率,平衡正向进行分析选项;
③依据浓度商和平衡常数比较得到反应进行的方向;
(4)当Fe3+完全沉淀时,即c(OH-)=$\root{3}{\frac{Ksp[Fe(OH)_{3}]}{c(F{e}^{3+})}}$=$\root{3}{\frac{1.0×l{0}^{-38}}{1.0×l{0}^{-5}}}$=1.0×10-11,因为Ksp[Al(OH)3]=4.0×l0-34,故c(Al3+)=$\root{3}{\frac{Ksp[Al(OH)_{3}]}{c(O{H}^{-})}}$=$\root{3}{\frac{4.0×1{0}^{-34}}{(1.0×1{0}^{-11})^{3}}}$=0.735,故w=$\frac{0.735}{1.05}$×100%=70%,据此进行分析.
解答 解:(1)由①4NH3(g)+3O2(g)═2N2(g)+6H2O(g)△H=-1266.5kJ/mol,
②N2(g)+O2(g)═2NO(g)△H=+180.5kJ/mol,
利用盖斯定律①-2×②可得:4NH3(g)+5O2(g)$\frac{\underline{催化剂}}{△}$4NO(g)+6H2O(g)△H=-905.5KJ/mol,
故答案为:4NH3(g)+5O2(g)$\frac{\underline{催化剂}}{△}$4NO(g)+6H2O(g)△H=-905.5KJ/mol;
(2)氨气可以构成燃料电池,其电池反应原理为4NH3+3O2=2N2+6H2O.氨分子中氮元素的化合价升高,发生氧化反应,应通入燃料电池的负极,电解质溶液为KOH溶液,负极的电极反应式为2NH3+6OH--6e-═N2+6H2O,
故答案为:2NH3+6OH--6e-═N2+6H2O;
(3)①温度升高,向吸热方向进行,由图象得,平衡常数减小,故逆向进行,故逆反应吸热,则正反应放热,△H<0,
故答案为:<;
③反应是N2+3H2$\frac{\underline{\;\;催化剂\;\;}}{高温高压}$2NH3,反应是气体体积减小的放热反应,为了增大平衡时H2的转化率,平衡正向进行分析,
A.增大压强,平衡正向进行,氢气转化率增大,故A符合;
B.使用合适的催化剂,改变反应速率,不能改变平衡,氢气转化率不变,故B不符合;
C.升高温度平衡逆向进行,氢气转化率减小,故C不符合;
D.及时分离出产物中的NH3,平衡正向进行,氢气转化率增大,故D符合;
故答案为:AD;
③Qc=$\frac{{3}^{2}}{2×{1}^{3}}$=4.5>K=0.5,说明反应向逆反应方向进行,因此v正(N2)<v逆(N2),
故答案为:<;
(4)当Fe3+完全沉淀时,即c(OH-)=$\root{3}{\frac{Ksp[Fe(OH)_{3}]}{c(F{e}^{3+})}}$=$\root{3}{\frac{1.0×l{0}^{-38}}{1.0×l{0}^{-5}}}$=1.0×10-11,因为Ksp[Al(OH)3]=4.0×l0-34,故c(Al3+)=$\root{3}{\frac{Ksp[Al(OH)_{3}]}{c(O{H}^{-})}}$=$\root{3}{\frac{4.0×1{0}^{-34}}{(1.0×1{0}^{-11})^{3}}}$=0.735,故w=$\frac{0.735}{1.05}$×100%=70%,
故答案为:70%.
点评 本题考查了热化学方程式的书写、燃料电池电极反应式的书写、化学平衡问题、浓度熵与平衡常数,综合性很强,题目难度较大.


 轻松暑假总复习系列答案
轻松暑假总复习系列答案科目:高中化学 来源: 题型:选择题
| A. | 若c(Fe2+)与c(Cu2+)相等时,该反应达到平衡状态 | |
| B. | 向平衡体系中加入少量硫酸铜晶体后,FeS的KSP减小 | |
| C. | 其他条件不变,增大FeS的物质的量,该反应的正反应速率增大 | |
| D. | 该反应的化学平衡常数K=$\frac{{K}_{sp}(FeS)}{{K}_{sp}(CuS)}$ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
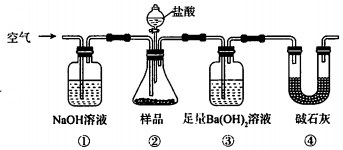
| A. | 必须在②③间添加吸收HCl的装置 | |
| B. | ④的作用是防止空气中的气体影响实验的精确度 | |
| C. | 通入空气的作用是保证②中产生的气体完全转移到③中 | |
| D. | 称取样品和③中产生的沉淀的质量即可求算Na2CO3固体的纯度 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
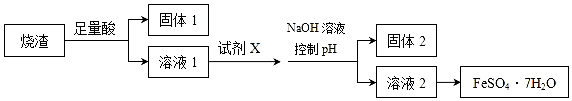
| A. | 溶液1中的阳离子可与NH4+、HCO3-、I-、SO42-在同一溶液中大量共存 | |
| B. | 向溶液2中加入3-5滴K3[Fe(CN)6](铁氰化钾)溶液,可观察到有蓝色沉淀生成 | |
| C. | 向固体2中加入足量NaOH溶液,发生反应的离子方程式:Al(OH)3+OH-=AlO2-+2H2O | |
| D. | 从溶液2得到FeSO4•7H2O产品的过程中,须控制条件防止其氧化和分解 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氯水(AgNO3溶液) | B. | NaOH溶液[Ba(OH)2溶液] | ||
| C. | FeSO4溶液(KSCN溶液) | D. | KI溶液(淀粉溶液) |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 平衡不移动 | |
| B. | 平衡向正反应方向移动,Cl2的转化率增大 | |
| C. | 平衡移动,且HClO浓度减小 | |
| D. | 平衡移动,且HClO浓度增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在18 g CD4中含有NA个碳原子 | |
| B. | 某无水乙醇与足量金属钠反应生成5.6LH2,该乙醇分子中共价键总数为4NA | |
| C. | 4.4g乙醛和丁酸的混合物完全燃烧,消耗氧分子的数目为0.25NA | |
| D. | 100mL浓度为lmol/L的蔗糖溶液中所含分子数为0.1NA |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 →
→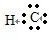
 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com