
| A. | 7.8gNa2O2中含阴离子的数目为0.1NA | |
| B. | 25℃时,1L pH=1的H2SO4溶液中含H+的数目为0.2NA | |
| C. | 9.0g淀粉和葡萄糖的混合物中含碳原子的数目为0.3NA | |
| D. | 将10mL 1mol/L FeCl3溶液滴入沸水中,所得氢氧化铁胶粒的数目为0.01NA |
分析 A、求出过氧化钠的物质的量,然后根据过氧化钠由2个钠离子和1个过氧根构成来分析;
B、pH=1的硫酸溶液中,氢离子浓度为0.1mol/L;
C、淀粉和葡萄糖的摩尔质量不同,且最简式也不同;
D、一个氢氧化铁胶粒是多个氢氧化铁的聚集体.
解答 解:A、7.8g过氧化钠的物质的量为0.1mol,而过氧化钠由2个钠离子和1个过氧根构成,故0.1mol过氧化钠中含有的阴离子为0.1NA个,故A正确;
B、pH=1的硫酸溶液中,氢离子浓度为0.1mol/L;,故1L溶液中含有的氢离子的物质的量为0.1mol,故个数为0.1NA个,故B错误;
C、淀粉和葡萄糖的摩尔质量不同,且最简式也不同,故9g淀粉和葡萄糖的混合物中含有的碳原子个数无法计算,故C错误;
D、一个氢氧化铁胶粒是多个氢氧化铁的聚集体,故将10mL 1mol/L FeCl3溶液滴入沸水中,所得氢氧化铁胶粒的数目小于0.01NA,故D错误.
故选A.
点评 本题考查了阿伏伽德罗常数的有关计算,难度不大,应注意公式的运用和物质的结构特点.


科目:高中化学 来源: 题型:选择题
| 选项 | A | B | C | D |
| 关系 | 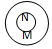 包含关系 | 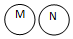 并列关系 | 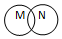 交集关系 | 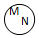 重叠关系 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
| 碳 | 氮 | Y | |
| X | 硫 | Z |
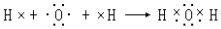 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
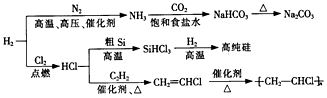
| A. | 使用催化剂可以降低合成氨反应的活化能 | |
| B. | 用澄清石灰水可以检验NaHCO3中是否混有Na2CO3 | |
| C. | 由粗硅制高纯硅的反应类型依次为化合反应、置换反应 | |
| D. | 聚合物 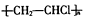 的链节为CH2=CHCl 的链节为CH2=CHCl |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| IA | IIA | IIIA | IVA | VA | VIA | VIIA | ||
| 二 | C | N | ① | |||||
| 三 | ② | ③ | ④ | P | ⑤ | ⑥ |
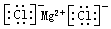 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH2=CHCOOH、CH3COOCH=CH2均可作为合成聚合物的单体 | |
| B. | C6Hn分子中的六个碳原子在同一直线上,则n可能等于2 | |
| C. | 2,2-二甲基丁烷与2,4-二甲基戊烷的一氯代物种类相同 | |
| D. | 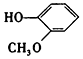 与 与 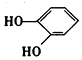 都是酚且互为同系物 都是酚且互为同系物 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .常温下Na2SiO3溶液的pH>(填“>”“<”或“=”) 7. ②用化学方程式表示该制备原理:2HCl+Na2SiO3+(n-1)H2O=SiO2•nH2O↓+2NaCl.
.常温下Na2SiO3溶液的pH>(填“>”“<”或“=”) 7. ②用化学方程式表示该制备原理:2HCl+Na2SiO3+(n-1)H2O=SiO2•nH2O↓+2NaCl.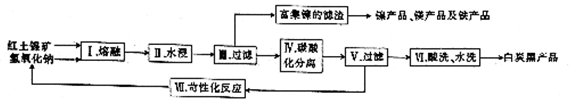
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com