
铬铁矿的主要成分可表示为FeO·Cr2O3,还含有MgO、Al2O3、Fe2O3等杂质,以下是以铬铁矿为原料制备重铬酸钾(K2Cr2O7)的流程图:
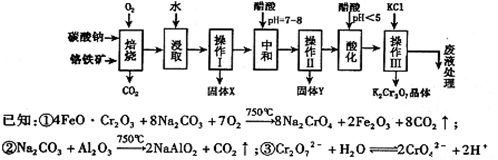
根据题意回答下列问题:
(1)操作Ⅰ的名称是 ,固体X中主要含有 (填写化学式);
(2)用醋酸调节溶液pH=7~8后再进行操作Ⅱ所得固体Y的成分为 (写化学式).
(3)酸化步骤中调节溶液pH<5时发生反应2CrO42-+2H+ 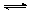 Cr2O72-+H2O.若将将醋酸改用盐酸,盐酸会与Cr2O72-反应造成大气污染并生成Cr3+杂质,该反应的离子方程式为 .
Cr2O72-+H2O.若将将醋酸改用盐酸,盐酸会与Cr2O72-反应造成大气污染并生成Cr3+杂质,该反应的离子方程式为 .
(4)下表是相关物质的溶解度数据,操作III发生反应的化学方程式是
Na2Cr2O7+2KCl=K2Cr2O7↓+2NaCl。该反应在溶液中能发生的理由是: 。

(5)含铬废渣(废水)的随意排放对人类生存环境有极大的危害。电解法是处理铬污染的一种方法,金属铁作阳极、石墨作阴极电解含Cr2O72-的酸性废水,一段时间后产生Fe(OH)3和Cr(OH)3沉淀。
 ①电解法处理废水的总反应如下,配平并填写空缺:(已知产物中n(Fe(OH)3): n (H2)=1:1)
①电解法处理废水的总反应如下,配平并填写空缺:(已知产物中n(Fe(OH)3): n (H2)=1:1)
___Fe+___Cr2O72-+___ +___H2O =___Fe(OH)3↓+___Cr(OH)3↓+___H2↑;
②已知常温下Cr(OH)3的Ksp=6.4×10–32mol4/l4,若Ⅰ类生活饮用水水质标准铬含量最高限值是0.052 mg/L,要使溶液中c(Cr3+)降到符合饮用水水质标准,须调节溶液的pH大于______。(已知lg2=0.3)
【知识点】常见金属元素的单质及其化合物的综合应用、制备实验方案的设计
【答案解析】 (1)漏斗、玻璃棒、烧杯(2分) Fe2O3、MgO(2分)
⑵Al(OH)3(2分) ⑶Cr2O72-+6Cl-+14H+=2 Cr3++3Cl2↑+7 H2O(2分)
⑷K2Cr2O7的溶解度比Na2Cr2O7小(或四种物质中K2Cr2O7的溶解度最小)。(2分)
⑸ ① 6,1,2H+,17,6,2,6 (6Fe+Cr2O72-+2H++17H2O = 6Fe(OH)3↓+2Cr(OH)3↓+6H2↑);(2分) ②5.6(2分)
解析:(1)铬铁矿的主要成分可表示为FeO•Cr2O3,还含有MgO、Al2O3、Fe2O3等杂质,加入氧气和碳酸钠,发生反应为:
①4FeO•Cr2O3+8Na2CO3+7O2=8Na2CrO4+2Fe2O3+8CO2↑;
②Na2CO3+Al2O3=2NaAlO2+CO2↑;
③Cr2CO72-+H2O⇌2CrO42-+2H+
操作Ⅰ是过滤,得到不溶于水的固体X为Fe2O3、MgO;(2)用醋酸调节溶液pH=7~8后,将偏铝酸根沉淀成氢氧化铝,再进行操作Ⅱ过滤所得固体Y为:Al(OH)3(3)Cr2O72-具有强氧化性,会将氧化成Cl2,方程式为:Cr2O72-+6Cl-+14H+=2 Cr3++3Cl2↑+7 H2O
(4)依据图表物质的溶解度分析对比,操作Ⅲ发生反应的化学方程式是:Na2Cr2O7+2KCl=K2Cr2O7↓+2NaCl;说明K2Cr2O7的溶解度比Na2Cr2O7小(或四种物质中K2Cr2O7的溶解度最小);(5)①根据化合价升降进行配平:6Fe+Cr2O72-+2H++17H2O = 6Fe(OH)3↓+2Cr(OH)3↓+6H2↑;②若地表水铬含量最高限值是0.1mg/L,换算成物质的量浓度c(Cr3+)=0.052×10-3÷52=1×10-6mol/L,要使溶液中c(Cr3+)降到符合地表水限值,已知Cr(OH)3的Ksp=6.4×10-32=c(Cr3+)×c3(OH-),须调节溶液的c(OH-)≥4×10-9mol/L
PH≥5.6;
【思路点拨】本题考查了物质制备流程和方案的分析判断,物质性质的应用,题干信息的分析理解,操作步骤的注意问题和基本操作方法是解题关键,题目难度中等。


科目:高中化学 来源: 题型:
SO2是一种大气污染物,某兴趣小组欲探究SO2的性质及绿色实验方法,设计如下方案:
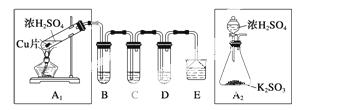
(1)B、C、D分别用于检验SO2的漂白性、还原性和氧化性。其中C、D分别为碘水和硫化氢的水溶液,则B中所盛试剂为__________,C中反应的离子方程式为____________________________。
(2)为了实现绿色实验的目标,某同学重新设计了如上右图A2的制取装置来代替A1装置,与A1装置相比,A2装置的优点是_____________________________________(任写一点即可)。
(3)E中用氨水吸收尾气中的SO2,“吸收液”中可能含有OH-、SO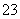 、SO
、SO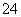 、HSO
、HSO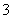 等阴离子。已知亚硫酸氢盐一般易溶于水,SO2也易溶于水。现有仪器和试剂为小烧杯、试管、玻璃棒、胶头滴管、过滤装置和滤纸;2 mol·L-1盐酸、2 mol·L-1 HNO3、1 mol·L-1 BaCl2溶液、1 mol·L-1 Ba(OH)2溶液、品红溶液、蒸馏水。请设计实验证明“吸收液”中存在SO
等阴离子。已知亚硫酸氢盐一般易溶于水,SO2也易溶于水。现有仪器和试剂为小烧杯、试管、玻璃棒、胶头滴管、过滤装置和滤纸;2 mol·L-1盐酸、2 mol·L-1 HNO3、1 mol·L-1 BaCl2溶液、1 mol·L-1 Ba(OH)2溶液、品红溶液、蒸馏水。请设计实验证明“吸收液”中存在SO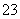 和HSO
和HSO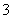 ,完成下表的实验操作、预期现象和结论:
,完成下表的实验操作、预期现象和结论:
| 实验操作 | 预期现象与结论 |
| 步骤1:取适量“吸收液”于小烧杯中,用胶头滴管取1 mol·L-1 BaCl2溶液向小烧杯滴加直至过量。 | 若出现白色浑浊,则溶液中存在SO |
| 步骤2:将小烧杯中的浊液过滤、洗涤,再用适量水把附在滤纸上的固体冲入另一小烧杯中;向冲下的固体______________。 | |
| 步骤3: |
查看答案和解析>>
科目:高中化学 来源: 题型:
用铝土矿(主要成分为Al2O3,含Fe2O3杂质)为原料冶炼铝的工艺流程如下:下列叙述正确的是( )
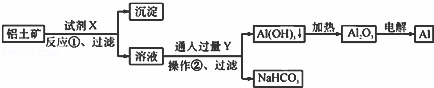
|
| A. | 试剂X可以是盐酸 |
|
| B. | 反应①过滤后所得沉淀为氢氧化铁 |
|
| C. | 图中所示转化反应都不是氧化还原反应 |
|
| D. | 操作②中发生的化学方程式为NaAlO2+2H2O+CO2=Al(OH)3↓+NaHCO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
右图小试管内为红墨水,具支试管内盛有pH=4久置的雨水和生铁片。实验观察到:开始时导管内液面下降,一段时间后导管内液面回升,略高于小试管内液面。下列说法正确的是
A.生铁片中的碳是原电池的负极,发生还原反应
B.雨水酸性较强,生铁片始终发生析氢腐蚀
C.墨水回升时,碳电极反应式为O2+2H2O+4e-===4OH-
D.具支试管中溶液酸性增强
查看答案和解析>>
科目:高中化学 来源: 题型:
下列叙述Ⅰ和Ⅱ均正确并且有因果关系的是 D
| 选项 | 叙述I | 叙述II |
| A | NH4Cl为强酸弱碱盐 | 用加热法除去NaCl中的NH4Cl |
| B | Fe3+具有氧化性 | 用KSCN溶液可以鉴别Fe3+ |
| C | 溶解度:CaCO3<Ca(HCO3)2 | 溶解度:Na2CO3<NaHCO3 |
| D | SiO2可与HF反应 | 氢氟酸不能保存在玻璃瓶中 |
查看答案和解析>>
科目:高中化学 来源: 题型:
从海带中提取碘的实验过程中(萃取剂用苯),涉及到下列操作,其中正确的是


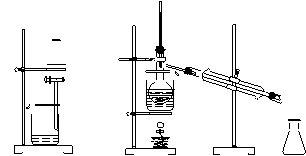

A.将海带灼 B.过滤得含 C.放出碘的 D.分离碘并回收苯
烧成灰 I-溶液 苯溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
棕榈科植物槟榔的干燥成熟种子可提取多种有机物,其中之一是异四氢烟酸,它具有镇痛和麻醉作
用,异四氢烟酸也可通过实验室合成,其中的一种合成路线如图所示
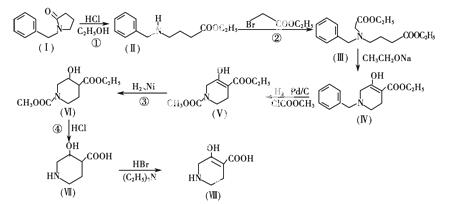
试回答下列问题
(1)属于取代反应的是________(选填序号①②③④)
(2)有机物Ⅳ中含有多种官能团,试写出两种________________。
(3)有机物(Ⅲ)在乙醇钠作用下,生成的另一种有机物是________。
(4)有机物Ⅷ(异四氢烟酸)可以通过加聚反应生成高分子化合物,写出该反应的化学方程式
____________________________________________________。
(5)X是有机物Ⅷ(异四氢烟酸)的一种同分异构体,请写出符合下列转化关系和条件的X的一种结构简式__________________。
X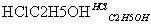 Y
Y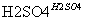 Z(X为一种常见的氨基酸,它的一种钠盐是味精的主要成分)
Z(X为一种常见的氨基酸,它的一种钠盐是味精的主要成分)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com