
| A. | 物质的量浓度相等CH3COOH和CH3COONa溶液等体积混合:c(CH3COO-)+c(CH3COOH)=2c(Na+) | |
| B. | 物质的量浓度相等Na2CO3和NaHCO3溶液等体积混合:离子浓度的大小顺序是:c (Na+)>c (HCO3-)>c(CO32-)>c(OH-)>c(H+) | |
| C. | CH3COONa溶液中c(OH-)=c(CH3COOH)+c(H+) | |
| D. | 1 mol/L Na2CO3溶液:c(OH-)=c(HCO3-)+c(H+)+c(H2CO3) |
分析 A.根据混合液中的物料守恒分析;
B.碳酸根离子的水解程度大于碳酸氢根离子,溶液呈碱性,据此进行判断各离子浓度大小;
C.根据醋酸钠溶液中的质子守恒判断;
D.根据碳酸钠溶液中的质子守恒判断.
解答 解:A.等体积等物质的量浓度的CH3COOH与CH3COONa混合,根据物料守恒可得:c(CH3COO-)+c(CH3COOH)=2c(Na+),故A正确;
B.物质的量浓度相等Na2CO3和NaHCO3溶液等体积混合,由于碳酸根离子的水解程度大于碳酸氢根离子,溶液呈碱性,则:c (HCO3-)>c(CO32-)、c(OH-)>c(H+),溶液中离子浓度的大小顺序是:c (Na+)>c (HCO3-)>c(CO32-)>c(OH-)>c(H+),故B正确;
C.CH3COONa溶液中,根据质子守恒可得:c(OH-)=c(CH3COOH)+c(H+),故C正确;
D.1mol/LNa2CO3溶液,根据质子守恒可得:c(OH-)=c(HCO3-)+c(H+)+2c(H2CO3),故D错误;
故选D.
点评 本题考查了离子浓度大小比较,题目难度中等,注意掌握盐的水解原理及其应用方法,明确电荷守恒、物料守恒及质子守恒的含义为解答关键,试题侧重考查学生的分析能力及灵活应用能力.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题
| A. | 光导纤维是一种能高质量传导光的玻璃纤维 | |
| B. | 光导纤维的抗干扰性能好,不发生电辐射,通讯质量高,能防窃听 | |
| C. | 高温结构陶瓷弥补了金属材料的弱点,但是硬度却远远低于金属材料 | |
| D. | 氮化硅陶瓷是一种重要的结构材料,具有超硬性,它能与氢氟酸反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Si 1s22s22p2 | B. | O2- 1s22s22p6 | ||
| C. | Na+ 1s22s22p6 | D. | Al 1s22s22p63s23p1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 判断H2O2分解速率的大小,可以通过测定单位时间内H2O2分解放出的O2的体积 | |
| B. | 制摩尔盐时用酒精洗涤产品 | |
| C. | 用米汤直接检验食用盐中是否含有碘元素 | |
| D. | 以硝酸钠和氯化钾为原料可以制备硝酸钾 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | C与A | B. | C与D | C. | D与B | D. | B与C |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 元素编号 | 元素性质或原子结构 |
| T | M层电子数比K层电子数多4个 |
| X | 最外层电子数是次外层电子数的2倍 |
| Y | 常温下单质为双原子分子,其氢化物水溶液呈碱性 |
| Z | 元素最高正价是+7价 |
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
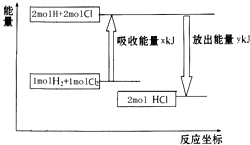
| A. | 该反应是放热反应 | |
| B. | 断裂1 mol H-H键和1 mol Cl-Cl 键放出x kJ能量 | |
| C. | 断裂1 mol H-Cl键需要吸收y kJ的能量 | |
| D. | 2 mol HCl的总能量高于1 mol H2和1 molCl2的总能量 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 纤维素在稀硫酸、加热的条件下水解 | |
| B. | 棉制品吸湿性好和分子中具有-OH有关 | |
| C. | 纤维指的就是纤维素 | |
| D. | 纤维素因分子结构中含-OH,可和浓HNO3发生硝化反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com