
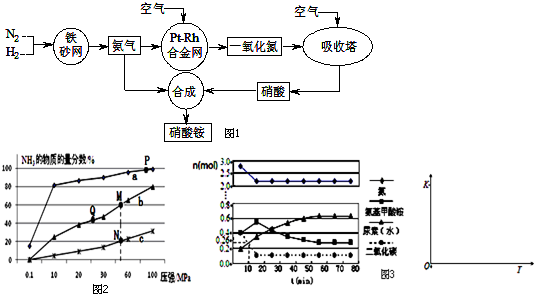
分析 (1)硝酸铵的水溶液中铵根离子水解会使溶液呈酸性,硝酸铵中硝酸根和铵根离子溶液相等,但部分铵根水解,浓度减小,据此判断离子浓度大小;
(2)①依据反应是放热反应,温度升高,平衡逆向进行,氨气的含量减小;
②A、减小生成物浓度平衡正向移动;B、P点原料气的平衡转化率接近100%,但此时压强为100MPa,对设备的要求太高,成本高,不是当前工业生产工艺中采用的温度、压强条件;C、K只受温度影响,该反应温度升高时K值减小;D、M点时氨的物质的量的分数为60%,根据反应N2(g)+3H2(g)?2NH3(g)利用三段式计算;E、根据反应N2(g)+3H2(g)?2NH3(g)利用三段式计算出平衡时各物质的浓度,并计算平衡常数;
(3)根据盖斯定律,①2NH3(g)+CO2(g)═H2NCOONH4(s)△H=-272kJ•mol-1;②H2NCOONH4(s)═CO(NH2)2(s)+H2O(g)△H=+138kJ•mol-1;将①+②可得以NH3、CO2为原料合成尿素的热化学方程式;
(4)①已知总反应的快慢由慢的一步决定,结合图象变化趋势,图象表达反应的判断,反应快慢可以依据第一步和第二步反应的曲线斜率比较大小;
②根据图象中二氧化碳在10 min时测得CO2的物质的量计算出用CO2表示的第一步反应的速率v(CO2);
③第二步反应为吸热反应,升高温度平衡向正反应方向移动,平衡常数增大,据此画图.
解答 解:(1)硝酸铵的水溶液中铵根离子水解会使溶液呈酸性,硝酸铵中硝酸根和铵根离子溶液相等,但部分铵根水解,浓度减小,所以溶液中离子浓度大小关系是c(NO3-)>c(NH4+)>c(H+)>c(OH-),
故答案为:酸性;c(NO3-)>c(NH4+)>c(H+)>c(OH-);
(2)①合成氨的反应为放热反应,反应温度越高,越不利于反应的进行,曲线a的氨气的物质的量分数最高,其反应温度对应相对最低,所以a曲线对应温度为200°C;
故答案为:200℃;
②A、及时分离出NH3,可以使平衡正向进行,可以提高H2的平衡转化率,故A正确;
B、P点原料气的平衡转化率接近100%,但此时压强为100MPa,对设备的要求太高,成本高,不是当前工业生产工艺中采用的温度、压强条件,故B错误;
C、平衡常数与温度有关,与其他条件无关,同一温度下的平衡常数相同,反应是放热反应,温度越高平衡常数越小,上图中M、N、Q点平衡常数K的大小关系是K(M)=K(Q)>K(N),故C正确;
D、M点时氨的物质的量的分数为60%,利用三段式,设H2转化率是x
根据反应N2(g)+3H2(g)?2NH3(g)
起始 1 3 0
转化 x 3x 2x
平衡 1-x 3-3x 2x
$\frac{2x}{1-x+3-3x+2x}$=60%,所以x=0.75,故D正确;
E、N点时氨的物质的量的分数为20%,利用三段式,设N2转化率是b,N2的起始浓度为a,
根据反应N2(g)+3H2(g)?2NH3(g)
起始 a 3a 0
转化 ab 3ab 2ab
平衡 a-ab 3a-3ab 2ab
根据题意有$\left\{\begin{array}{l}{\frac{2ab}{a-ab+3a-3ab+2ab}=20%}\\{2ab=0.2mol•{L}^{-1}}\end{array}\right.$,所以a=0.3mol•L-1,b=$\frac{1}{3}$,所以平衡常数K=$\frac{(2ab)^{2}}{(a-ab)•(3a-3ab)^{3}}$=0.93,故E正确,
故选:ACDE;
(3)根据盖斯定律,①2NH3(g)+CO2(g)═H2NCOONH4(s)△H=-272kJ•mol-1;②H2NCOONH4(s)═CO(NH2)2(s)+H2O(g)△H=+138kJ•mol-1;将①+②可得以NH3、CO2为原料合成尿素的热化学方程式为2NH3(g)+CO2(g)?H2O(g)+CO(NH2)2 (s)△H=-134kJ/mol,
故答案为:2NH3(g)+CO2(g)?H2O(g)+CO(NH2)2 (s)△H=-134kJ/mol;
(4)①由图象可知在15分钟左右,氨气和二氧化碳反应生成氨基甲酸铵后不再变化发生的是第一步反应,氨基甲酸铵先增大再减小最后达到平衡,发生的是第二部反应,从曲线斜率不难看出第二步反应速率慢,所以合成尿素总反应的快慢由第二步反应决定,根据图可知,尿素在55分钟时,物质的量不再变化,即反应达到平衡,所以总反应进行到55min时到达平衡,
故答案为:二;55;
②反应进行到10 min时测得CO2的物质的量为0.26mol,二氧化碳的浓度变化为:c(CO2)=$\frac{1mol-0.26mol}{0.5L}$=1.48mol/L,
则用CO2表示的第一步反应的速率v(CO2)=$\frac{1.48mol/L}{10min}$=0.148 mol/(L•min),
故答案为:0.148;
③第二步反应为吸热反应,升高温度平衡向正反应方向移动,平衡常数增大,所以第二步反应的平衡常数K随温度的变化的示意图为 ,
,
故答案为: .
.
点评 本题考查了热化学方程式的书写、化学平衡的计算,题目难度中等,注意掌握盖斯定律的内容及应用方法,能够利用三段式进行化学平衡的计算,明确反应速率的概念及计算方法,试题培养了学生的分析、理解能力及化学计算能力.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 只被氧化 | B. | 被氧化与被还原的个数比为1:3 | ||
| C. | 只被还原 | D. | 氧化剂与还原剂的质量比是1:3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2g氢气所含原子数目为NA | |
| B. | 标准状况下,11.2L H2O所含分子数为0.5NA | |
| C. | 1mol•L-1 CaCl2溶液中所含Ca2+离子的数目为NA | |
| D. | 由CO2和O2组成的混合物中共有NA个分子,其中的氧原子数为2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
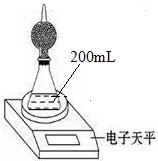 如图是测定铝粉(含铜粉等杂质不与酸反应)的纯度的实验装置.装置为干燥管和锥形瓶,干燥管内装有氯化钙,锥形瓶内所用的硫酸(足量)的物质的量浓度为4mol•L-1.不同时间电子天平的读数如下表所示:
如图是测定铝粉(含铜粉等杂质不与酸反应)的纯度的实验装置.装置为干燥管和锥形瓶,干燥管内装有氯化钙,锥形瓶内所用的硫酸(足量)的物质的量浓度为4mol•L-1.不同时间电子天平的读数如下表所示:| 实验操作 | t/min | 电子天平的读数/g |
| 装置+硫酸溶液 | 320.0 | |
| 装置+硫酸溶液+样品 | 0 | 335.0 |
| 1 | 334.5 | |
| 2 | 334.1 | |
| 3 | 333.8 | |
| 4 | 333.8 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
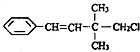 ,关于该有机物的下列叙述中不正确的是( )
,关于该有机物的下列叙述中不正确的是( )| A. | 一定条件下,能发生加聚反应 | |
| B. | 1mol该有机物在一定条件下最多能与4molH2发生反应 | |
| C. | 能使酸性KMnO4溶液、溴水褪色,且原理相同 | |
| D. | 该有机物苯环上的一溴代物有3种 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com