
| 0.5825g |
| 233g/mol |
| 0.02000mol/L×0.025L |
| 2 |
| 1.7700g-0.01mol×142g/mol-0.005mol×34g/mol |
| 18g/mol |
| 0.5825g |
| 233g/mol |
| 0.02000mol/L×0.025L |
| 2 |
| 1.7700g-0.01mol×142g/mol-0.005mol×34g/mol |
| 18g/mol |


 小学教材全测系列答案
小学教材全测系列答案 小学数学口算题卡脱口而出系列答案
小学数学口算题卡脱口而出系列答案 优秀生应用题卡口算天天练系列答案
优秀生应用题卡口算天天练系列答案 浙江之星课时优化作业系列答案
浙江之星课时优化作业系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 1 |
| 2 |
| 3 |
| 2 |
| A、Mg(OH)2和Al(OH)3高温下不分解,所以可做工业阻燃剂 |
| B、等质量Mg(OH)2和Al(OH)3相比,Mg(OH)2阻燃效果较好 |
| C、Mg(OH)2比Al(OH)3热稳定性高 |
| D、Mg(OH)2和Al(OH)3作为工业阻燃剂与它们分解吸热及生成物具有耐高温性有关 |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
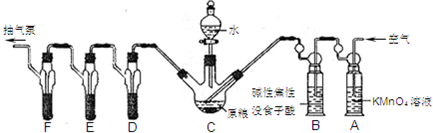
查看答案和解析>>
科目:高中化学 来源: 题型:
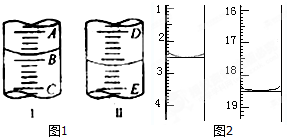
查看答案和解析>>
科目:高中化学 来源: 题型:
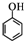 )和CH2=CH2为原料制备有机物
)和CH2=CH2为原料制备有机物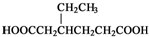 的合成路线流程图(无机试剂任用).
的合成路线流程图(无机试剂任用).| HBr |
| NaOH溶液 |
| △ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、1mol过氧化钠与水反应转移电子数为NA |
| B、0.1mol氯化铁水解制成胶体,所得胶体粒子数为0.1NA |
| C、标准状况下,22.4L水中含有水分子数为NA |
| D、1L 0.1mol每升乙酸溶液中氢离子数为0.1NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com