
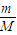 ,n(Cu)=
,n(Cu)=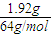 =0.03mol,
=0.03mol, =
=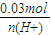 n(H+)═0.08mol>0.06mol 该反应中铜过量.
n(H+)═0.08mol>0.06mol 该反应中铜过量. =
=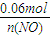 ,解得n(NO)=0.015mol,
,解得n(NO)=0.015mol,

 文敬图书课时先锋系列答案
文敬图书课时先锋系列答案科目:高中化学 来源: 题型:
| 1 | 10 |
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
| 实验序号 | FeSO4溶液的体积读数/mL | |
| 滴定前 | 滴定后 | |
| 1 | 0.10 | 16.20 |
| 2 | 0.30 | 15.31 |
| 3 | 0.20 | 15.19 |
查看答案和解析>>
科目:高中化学 来源:2012年沪科版高中化学7.1探究电解质溶液的性质练习卷(解析版) 题型:选择题
某溶液100mL,室温时测得其pH等于1。下列叙述中不正确的是:
A.该溶液[H+]≥0.1mol/L
B.把该溶液稀释成1L后,pH≥2
C.把该溶液稀释成1L后,pH≤2
D.中和此溶液需0.1mol/L的NaOH溶液的体积≥100mL
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
查看答案和解析>>
科目:高中化学 来源: 题型:
用铅蓄电池作电源电解某溶液100mL。已知该溶液中含SO2、KI,其物质的量的浓度均为
0.1mol/L,如图所示(C1、C2为石墨电极),下列说法正确的是 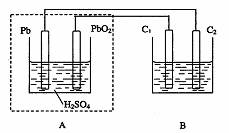
A.铅蓄电池工作一段时间后A溶液的pH变小
B.当B烧杯中I-的浓度降为0.05mol/L时,消耗A中的H2SO4的物质的量为0.025mol
C.当C1、C2两极均产生气体时,应有至少3.6×1022个电子从电路中流过
D.铅蓄电池工作时负极电极反应式为:PbO2-2e-+H2SO4 PbSO4+2H2O+SO42-
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com