
【题目】常温下,用0.1mol/LNaOH溶液滴定10 mL 0.1 mol/LH2A溶液,溶液的pH与NaOH溶液的体积关系如图所示。下列说法不正确的是( )

A.A点溶液中加入少量水:![]() 增大
增大
B.B点:c( HA -)>c(H+)>c(A2一)>c(H2A)
C.C点:c(Na+) =c(HA-)+2c( A2-)
D.水电离出来的c(OH -):B点>D点
【答案】D
【解析】
试题分析:A、0.1mol·L-1的H2A的溶液的pH>1,说明是弱酸,存在平衡:H2A ![]() HA-+H+,HA-
HA-+H+,HA-![]() H++A-,加水促进电离,c(OH-)增大,c(H2A)的减小,因此比值增大,故说法正确;B、加入10mLNaOH溶液,溶质为NaHA,溶液显酸性,说明HA-的电离程度大于水解,因此微粒浓度是c(Na+)>c(HA-)>c(H+)>c(A2-)>c(H2A),故说法正确;C、根据电荷守恒,c(Na+)+c(H+)=c(OH-)+c(HA-)+2c(A2-),溶液显中性,即c(H+)=c(OH-),有c(Na+) =c(HA-)+2c( A2-),故说法正确;D、20mL的NaOH溶液中溶质为Na2A,D点促进水的电离,B点是抑制水的电离,因此D点大于B点,故说法正确。
H++A-,加水促进电离,c(OH-)增大,c(H2A)的减小,因此比值增大,故说法正确;B、加入10mLNaOH溶液,溶质为NaHA,溶液显酸性,说明HA-的电离程度大于水解,因此微粒浓度是c(Na+)>c(HA-)>c(H+)>c(A2-)>c(H2A),故说法正确;C、根据电荷守恒,c(Na+)+c(H+)=c(OH-)+c(HA-)+2c(A2-),溶液显中性,即c(H+)=c(OH-),有c(Na+) =c(HA-)+2c( A2-),故说法正确;D、20mL的NaOH溶液中溶质为Na2A,D点促进水的电离,B点是抑制水的电离,因此D点大于B点,故说法正确。


科目:高中化学 来源: 题型:
【题目】右图为实验室制取少量乙酸乙酯的装置图。下列关于该实验的叙述中,不正确的是
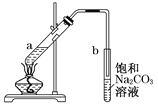
A. 向a试管中先加入浓硫酸,然后边摇动试管边慢慢加入乙醇,再加冰醋酸
B. 试管b中导气管下端管口不能浸入液面的目的是防止实验过程中产生倒吸现象
C. 实验时加热试管a的目的之一是及时将乙酸乙酯蒸出,使反应向生成乙酸乙酯的方向移动
D. 试管b中饱和Na2CO3溶液的作用是吸收随乙酸乙酯蒸出的少量乙酸和乙醇
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】分子式为C5H10O2的有机物在酸性条件下可水解为酸和醇,若不考虑立体异构,这些酸和醇重新组合可形成的酯共有
A.15种 B.28种 C.32种 D.40种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】汽车尾气中的氮氧化物对大气造成污染,NO是其组成之一.已知N和O的核电荷数分别是7和8,则2个NO分子共含有的电子个数为( )
A.14
B.15
C.16
D.30
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学反应方程式是化学学习的基本工具,本期在化学反应与化学平衡章节学过几个重要的化学方程式,请你按要求写出:
(1)硫代硫酸钠与稀硫酸溶液反应的离子方程式:
(2)碘化钾的稀硫酸溶液与空气中氧气反应的离子方程式:
(3)在重铬酸钾的硫酸溶液中的Cr2O72—与CrO42—之间转化的离子方程式:
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D均为中学所学的常见物质且均含有同一种元素,它们之间的转化关系如下图所示(反应条件及其他物质已经略去):![]()
(1)若A为H2S,D的水溶液能使湿润的蓝色石蕊试纸变红,B为刺激性气味气体,写出B→C转化的化学反应方程式:________________________________________。
(2)若A的水溶液能使湿润的红色石蕊试纸变蓝,D的稀溶液能使湿润的蓝色石蕊试纸变红:A的化学式为______,实验室制备气体A的化学反应方程式__________________________,A→B转化的化学方程式为_____________________________________________________。
(3)若A为活泼金属元素的单质,D为强碱,焰色反应显黄色,则B是(填化学式)________, C可作为呼吸面具的填充剂,C与二氧化碳发生反应的化学方程式为________________________________,C与水发生反应的离子方程式为___________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某些化学反应可用下式表示:A + B →C + D +H2O请回答下列问题:
(1)若A、C、D均含有氯元素,且A的化合价介于C与D之间,写出该反应的离子方程式:________________。
(2)若C为氯化钠,D能使澄清石灰水变浑浊的无味气体,则A与B的组合是:______________或______________。
(3)若A为MnO2,B为盐酸,C是黄绿色的单质气体,写出该反应的离子方程式___________________。
(4)若A为单质,B为硝酸,请写出符合上式的化学方程式__________________。
(5)若C、D均为气体且都能使澄清石灰水变浑浊,且D可以使品红褪色,则A与B反应的化学方程式____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】盖斯定律在生产和科学研究中有很重要的意义。有些反应的反应热虽然无法直接测得,但可通过间接的方法测定。现根据下列的3个热化学反应方程式:
Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g)△H=-24.8kJ/mol
Fe2O3(s)+![]() CO(g)=
CO(g)=![]() Fe3O4(s)+
Fe3O4(s)+![]() CO2(g)△H=-15.73kJ/mol
CO2(g)△H=-15.73kJ/mol
Fe3O4(s)+CO(g)==3FeO(s)+CO2(g) △H=+640.4kJ/mol
试写出CO气体还原FeO固体得到Fe固体和CO2气体的热化学反应方程式: 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了证明醋酸是弱电解质,四同学分别进行实验:甲用pH试纸测出0.10 mol/L的醋酸溶液pH = 4;乙将pH = 3醋酸和盐酸,各取10 mL,用蒸馏水稀释到原来的100倍,然后用pH试纸测定该溶液的pH,醋酸的变化小;丙将pH = 3醋酸和盐酸,分别加入相应的钠盐固体,醋酸的pH变化大;丁取pH = 3醋酸和盐酸,分别稀释到原来的100倍,然后加入完全一样的锌粒,测量醋酸放出H2的速率快。
A.一位同学 B.二位同学 C.三位同学 D.四位同学
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com